7440-39-3
 7440-39-3 结构式
7440-39-3 结构式
物理化学性质
安全数据
应用领域
7440-39-3(安全特性,毒性,储运)
常见问题列表
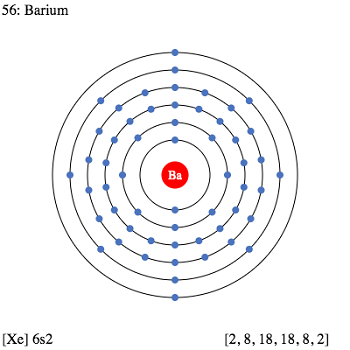
元素Ba; 原子序数56; 原子量137.327; IIA组(第2主组)碱土元素。 钡是银白色金属。自然界中它仅存在于含有元素混合物的矿石中。重要的组合是过氧化物,氯化物,硫酸盐,碳酸盐,硝酸盐和氯酸盐。钡与铅,钾,铂,镁,硅,锌,铝和汞形成合金和金属间化合物。钡化合物与也是碱土金属的钙和锶化合物显示出密切的关系。现已鉴定出25种钡同位素,其中138Ba最丰富,其余为不稳定同位素,半衰期从140Ba的12.8天到143Ba的12 s。这些同位素中的两个131Ba和139Ba在研究中用作放射性示踪剂。
中世纪初,炼金术士即对一些钡矿石有所了解。在意大利博洛尼亚发现的一些被称为“博洛尼亚石”的平滑卵石状重晶石块曾得到炼金术士的注意,因为这些矿石在受到光照后会发光数年。1602年,卡西奥劳罗(V. Casciorolus)描述了这种用有机物加热重晶石发出磷光的性质。 1774年,卡尔·威廉·舍勒发现重晶石中含有一种未发现的新元素,但无法分离提纯这种元素,只能得到它的氧化物,即氧化钡。两年后,约翰·戈特利布·甘恩也在相同的研究中得到了氧化钡。氧化钡最早被Guyton de Morveau称作“barote”,后来被拉瓦锡改作“baryta”。同在18世纪,英国矿物学家威廉·威灵宁在坎伯兰的铅矿中注意到一种沉重的矿物,现在称为毒重石,其主要成分为碳酸钡。1808年,汉弗里·戴维首次通过电解熔融的钡盐分离钡单质。戴维通过与钙类似的命名方法,用重晶石(baryta)的名称加上表示元素的后缀-ium来命名钡(barium)。罗伯特·本生与奥古斯都·马修森通过电解氯化钡和氯化铵的熔融混合物来获得纯钡。
钡是地壳中第17个最丰富的元素,约占地壳的0.05%。 它在镁铝石矿中发现,其为碳酸钡(BaCO3)和重晶石,称为硫酸钡(BaSO4)。 纯钡金属在地球上不存在,仅以化合物形式存在或存在于矿物和矿石中。 在密苏里州,阿肯色州,乔治亚州,肯塔基州,内华达州,加利福尼亚州,加拿大和墨西哥发现了钡矿石,它是通过在高温真空下使用铝或硅还原氧化钡(BaO)制成的。 它也是通过在约950℃的温度下电解熔融氯化钡(BaCl2)来生产的,其中钡金属在阴极收集,氯气在阳极排放。

钡的最重要用途是作为电子管中的清除剂。这种金属通常为粉末形式或与铝形成合金,用于去除真空和电视显像管中的最后痕量气体。钡合金具有许多应用。它被结合到酸性电池的铅合金网格中以实现更好的性能;并添加到脱氧合金中的钢水和金属中以降低氧含量。钡薄膜用作润滑剂,适合在高温下在真空X射线管中的阳极转子上以及在用于火花塞的合金上使用。该元素的几种放射性同位素可用于核反应和光谱学中。
开采出的矿石需要经过洗涤、粉碎、分类,并与石英分离。如果石英渗入矿石过深,或者矿石中铁、锌、铅含量过高,则须使用泡沫浮选法处理。最终得到的产物是质量分数98%的重晶石,纯度不低于95%,且铁和二氧化硅含量极少。
随后使用碳还原硫酸钡:
BaSO4 + 2 C → BaS + 2 CO2↑
生成了水溶性的硫化钡之后,便可以作为其它产品的原料:与氧反应得到硫酸钡,与硝酸生成硝酸钡,与二氧化碳生成碳酸钡等。硝酸钡加热分解可以产生钡的氧化物。
金属钡可以用氧化钡在1,100 °C(2,010 °F)下与铝反应得到。
其中首先生成金属互化物BaAl4:
3 BaO + 14 Al → 3 BaAl4 + Al2O3
BaAl4是与氧化钡反应生成金属的中间产物。注意并非全部钡元素都被还原。
8 BaO + BaAl4 → Ba↑ + 7 BaAl2O4
剩余的氧化钡与生成的氧化铝反应:
BaO + Al2O3 → BaAl2O4
总反应为:
4 BaO + 2 Al → 3 Ba↑ + BaAl2O4
钡蒸气在氩气气氛中冷凝并装入模具中。这种方法在商业上用于生产超纯钡。通常市面上出售的钡纯度约99%,主要杂质为锶和钙(含量达到0.8%和0.25%),而其他杂质成分小于0.1%。 硫酸钡与硅在1,200 °C(2,190 °F)下亦可发生类似的反应得到钡和偏硅酸钡。但工业上一般不会使用电解法,因为钡易溶于熔融的卤化物,并且产物纯度较低。
知名试剂公司产品信息
Barium crystalline dendritic solid, 99.9% (metals basis)(7440-39-3)


