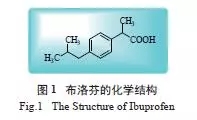
布洛芬(ibuprofen),化学名为2-(4- 异丁基苯基) 丙酸( 图1),是临床上广泛应用的非甾体抗炎药(non-steroidal antiinflammatory drugs,NSAIDs)。许多临床研究显示,布洛芬相对于其他类型的退热药物,退热效果好、不良反应少且能缩短病程,被广泛应用于治疗关节炎、神经炎、强制性脊髓炎及一般的解热镇痛。有研究表明,慢性摄入非甾体抗炎药如布洛芬,可降低中枢神经系统疾病的发病风险,甚至延缓其发病。此外,服用布洛芬还可降低结肠癌和胰腺癌的发病风险。
布洛芬的抗炎作用机制是抑制花生四烯酸的环氧合酶(cyclooxygenase,COX) 途径,减少前列腺素(PGs) 的合成,使前列腺素所致的局部组织充血、肿胀、发热得到减轻。布洛芬还能抑制白细胞活动及溶酶体释放,从而降低局部周围神经对缓激肤等致痛物质的痛觉敏感性,减少组织冲动,起到镇痛作用。COX存在3种同工酶:COX-1、COX-2和COX-3。其中COX-1有保护胃肠道、维持正常肾功能和凝血的作用;COX-2参与炎症、细胞增生和神经退行性疾病的过程;COX-3于2002年被发现,有介导疼痛的作用。布洛芬同时抑制COX-1和COX-2,IC50分别为7.6 和20μmol/L。结构生物学研究表明,COX-2的催化活性腔要比COX-1的大25%,主要是由于2个氨基酸残基的不同所导致的:503位的Phe变为Leu使活性腔顶部的空间扩大,523位的Ile变为Val使一个侧面口袋被打开。研究发现布洛芬并没有占据COX-2口袋的结构片段,这就使布洛芬对这2种同工酶缺乏选择性。
布洛芬虽然具有良好的安全性,但长期使用布洛芬仍会引起胃肠黏膜的刺激、溃疡以及肾功能损害等不良反应。其中胃肠道疾病一般被认为是由直接接触效应所致,即分子结构中游离的羧基产生的局部刺激,也和抑制COX-1引起的胃肠道前列腺素生物合成受阻这个因素有关。为此,研究人员也投入了大量的财力物力去研发COX-2抑制剂。但也有文献报道COX-2抑制剂存在使心血管疾病风险增加,以及可能导致急性肾功能衰竭的不良反应,在使用上也存在着一定的争议。
所以,目前布洛芬结构修饰的主要方向是通过结构改造提升布洛芬对COX-2的选择性。利用前药原理将羧基修饰成其他基团,从而减小对胃肠道的刺激,以及利用拼合原理将布洛芬与具有相似或不同药理作用的药物通过共价键相连,以增强布洛芬的抗炎活性或产生新的药理活性,从而寻找生物利用度高、不良反应小、抗炎活性强的候选药物。本文根据不同的结构修饰部位,对近年来报道的基于布洛芬的结构修饰产物进行综述,并对其发展前景进行简要评述。
1 苯环上的修饰
苯环上的修饰主要集中在上世纪刚发现布洛芬后进行me-too 药物的研究中。对于苯丙酸来说,疏水取代基一般在4-位时抗炎活性会比较好,2、3-位时活性较弱。但也有例外,比如已经上市的菲诺洛芬、酮洛芬。之前的研究也发现把4-位异丁基替换成环己基具有很好的活性,但因后者可能导致溃疡而被放弃。
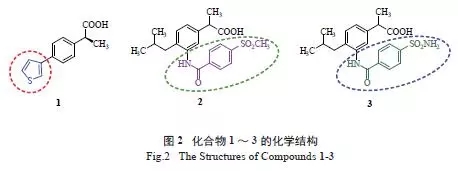
Mittal等合成了S构型的对位取代基为3-噻吩基的苯基乙酸化合物1(图2),并对其活性和COX选择性进行了评价。体外实验表明,1表现出较好的COX-1/COX-2选择性,在角叉菜胶诱导的鼠足水肿模型中对其抗炎活性进行评价,其ED50=1.85mg/kg,优于S构型的布洛芬(ED50=5.74mg/kg)。
2 羧基的改造
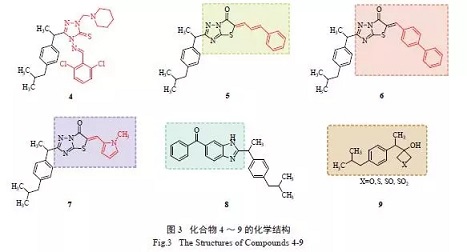
Sujith 等推测,布洛芬非选择性地起作用可能是由于其体积相对较小,更大的分子结构可能更能赋予其选择性。此外,有文献报道1,2,4-三唑及其衍生物,以及Mannich碱也具有一定的生物活性。由此,合成了一系列将布洛芬上羧基替换成3-硫醇-4-氨基三唑的化合物及其Schiff 碱和Mannich碱衍生物,并采用角叉菜胶诱导的大鼠足水肿模型来评价其抗炎活性。实验结果表明,Schiff碱衍生物和Mannich碱衍生物都表现出优异的抗炎作用,在每个时间间隔均表现出高于布洛芬的活性,其中Mannich碱的活性比Schiff碱更高。其中化合物4( 图3) 被报道具有的抗炎活性及很好的镇痛活性。其抗炎活性优于布洛芬及双氯芬酸,小鼠热板法评价其镇痛活性也与双氯芬酸相似。
3 羧酸衍生物
近年来,许多研究着眼于发展布洛芬前药的开发,通常来说布洛芬的酯或酰胺衍生物更有利于被转运到达活性部位,然后被酶分解成活性药物。由于其代谢途径的改进,这类化合物的胃部不良反应有所降低。
4 有机合成方法学在布洛芬结构修饰中的应用
从上述对布洛芬结构修饰进展的阐述不难发现,许多工作都集中在成酯修饰和成酰胺修饰方面。将游离的羧基进行保护的确是降低其致胃溃疡性的一个方向,但也从另一个角度说明,高效且高选择性地在布洛芬的特定位置添加取代基,仍然是一个非常具有挑战性的问题。
近年来也发展了许多能够对布洛芬进行修饰的方法学。例如,Song等用N- 氰基-N-苯基对甲苯磺酰胺作为氰基源,实现了布洛芬的脱羧氰基化(Eq.1)。Capaldo等用四丁基铵十聚钨酸盐作光催化剂,芳基乙酸作为苄基自由基来源,实现了贫电子烯烃的苄基化,可用布洛芬与反丁烯二腈一步制备2-[1-(4-异丁基苯基) 乙基] 琥珀腈(Eq.2)。Lang 等开发了一种非金属催化的脱羧胺化反应,该反应也可用于芳基丙酸和扁桃酸衍生物的修饰(Eq.3)。Huang 等报道了首例使用亲核性氟离子实现的脱羧氟化反应(Eq.4),该方法可很容易地使氟取代各种脂肪羧酸基团。各反应式见图11。
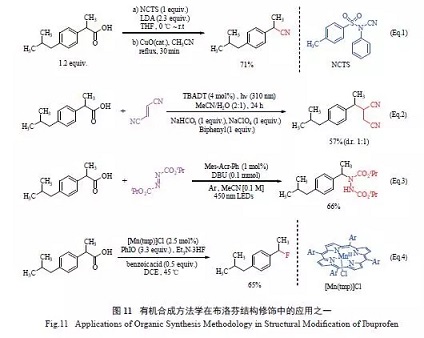
除了脱羧生成苄基自由基后与其他官能团偶联这一策略外,布洛芬的异丁基或羧基α-位的选择性氧化等也得以实现。McNeill等用单核钌(Ⅲ)作催化剂、CAN作氧化剂,实现了非活化苄基的选择性氧化(Eq.5)。Liang等报道了以氧气作氧源、以Cs2CO3催化的羰基α-位羟基化反应。通过酯化、氧化和水解3 步,可以69%的收率得到α-位羟基取代的布洛芬(Eq.6)。此外,Nagib 等使用条件温和、操作简便的策略,通过自由基介导的机制,对未活化的芳烃和杂芳烃进行直接三氟甲基化(Eq.7),遗憾的是三氟甲基自由基会在布洛芬芳香区的2个位置上发生烷基化,故对于布洛芬来说该反应选择性较差。
5 展望
近年来对布洛芬的结构修饰主要集中在将羧基转变为羧酸衍生物这个方向。其主要优点在于可避免裸露的羧基对肠胃的刺激,此外,也有一些研究报道修饰后的布洛芬对COX-2的选择性有所提升。这两个因素使得羧酸衍生物与布洛芬相比,长期服用导致患者发生胃溃疡的风险性大大降低,具有良好的安全性。其中许多化合物已被作为候选药物深入研究。
目前也有很多将布洛芬与其他药物或药效基团相连接,通过作用于其他不同的靶点,起到抗菌、抗中枢神经退行性疾病、抗肿瘤等新药理作用的工作被报道,其具体的作用机制还有待进一步研究。这些工作对研究者们在结构设计和活性测试等方面有所启示。此外,一些将布洛芬与靶向基团偶联从而实现布洛芬在体内靶向分布的研究报道,为将布洛芬靶向输送至脑内,进而治疗中枢神经退行性疾病提供了基础。
尽管如此,在布洛芬结构修饰的研究中,仍有许多问题需要解决。例如到目前为止,运用计算、结构模拟等方法将布洛芬设计改造为COX-2选择性抑制剂的报道仍然较少,且其对于COX-2的抑制能力与已上市的COX-2抑制剂相比还有很大差距。对布洛芬一些非活化位点进行结构修饰的方法仍然较少,有待进一步开发。这些问题的解决,还需要科研工作者进一步的努力。相信在不久的将来,布洛芬的结构修饰产物会在抗炎镇痛以及阿尔茨海默病或肿瘤的治疗方面,为人类的健康做出更大贡献。也相信布洛芬结构修饰所使用的策略和方法,也会对其他药物的研发和结构修饰有所启发。
