三氧化二铁
| 中文名称 | 三氧化二铁 |
|---|---|
| 中文同义词 | 纳米三氧化二铁(Α- FE2O;铁红(E172);纳米磁性氧化铁(Γ-FE2O3;三氧化二铁,99.999%,-100MESH;氧化铁(III), Α-相, 99% (METALS BASIS);氧化铁(III),PURATRONIC, 99.998% (METALS BASIS);氧化铁(III), COSMETIC, NANOARC;氧化铁(III), 磁性, NANOARC |
| 英文名称 | Ferric oxide |
| 英文同义词 | Ferric oxide(II,III), magnetic nanoparticles solution;Ferric(III) oxide;Iron(III) oxide, 99% trace metals basis;Iron(III) oxide, 99.9% trace metals basis;Iron(III) oxide, 98% trace metals basis;Iron(III) oxide, 99.95% trace metals basis;Iron(III) oxide, 99.99% trace metals basis;Iron(lll) oxide |
| CAS号 | 1309-37-1 |
| 分子式 | Fe2O3 |
| 分子量 | 159.69 |
| EINECS号 | 215-168-2 |
| 相关类别 | 其它金属;生化试剂;稀土;食用色素;镀膜材料;催化和无机化学;Ct氧化物;无机化工产品;无机盐;食品添加剂;食用色素(着色剂);食用色素与护色剂;无机颜料;颜料;通用试剂;铁;其他生化试剂;食用色素类;无机化合物和盐;生化试剂-其他化学试剂;氧化物;化工原料;医用原料;中间体类;Inorganics;metal oxide;常规氧化物粉体-三氧化二铁;有机化工原料;化工材料;合成材料中间体-高分子材料;氧化物;其他;医药原料;金属粉末;其他原料;无机化工原料 |
| Mol文件 | 1309-37-1.mol |
| 结构式 | 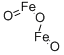 |
三氧化二铁 性质
| 熔点 | 1538°C |
|---|---|
| 密度 | 5.24 |
| 闪点 | >230 °F |
| 储存条件 | 2-8°C |
| 溶解度 | 溶于温盐酸,微溶于硫酸。 |
| 形态 | 片状 |
| 颜色 | 黑色 |
| 比重 | 5.1~5.2 |
| PH值 | 3.7±0.3 |
| 水溶解性 | INSOLUBLE |
| Merck | 14,4028 |
| 暴露限值 | ACGIH: TWA 5 mg/m3 OSHA: TWA 10 mg/m3; TWA 15 mg/m3; TWA 5 mg/m3 NIOSH: IDLH 2500 mg/m3; TWA 5 mg/m3 |
| 稳定性 | 稳定的。 |
| CAS 数据库 | 1309-37-1(CAS DataBase Reference) |
| (IARC)致癌物分类 | 3 (Vol. 1, Sup 7) 1987 |
| NIST化学物质信息 | Iron(iii) oxide(1309-37-1) |
| EPA化学物质信息 | Ferric oxide (1309-37-1) |
三氧化二铁又称铁丹、铁红、红粉等,化学式Fe2O3,溶于盐酸,为三方晶系红色透明粉末。粒子细,粒径为0.01~0.05 μm,比表面积大(为普通氧化铁红的10倍), 具有强烈的吸收紫外线性能,耐光、耐大气性能优良。当光线投射到含有透明氧化铁红颜料的漆膜或塑料时,呈透明状态。相对密度5.7g/cm3,熔点1396℃。是铁系颜料中具有独特性能的新品种。

氧化铁颜料有着卓越的着色性能,在陶瓷中主要利用氧化铁的着色性,配制各种色彩的釉水,由于铁离子的价位不同,铁氧化物本身就呈现不同颜色。如:三氧化二铁(Fe2O3)为红色粉末,氧化亚铁(FeO)及四氧化三铁(Fe3O4)为黑色粉末。另外,在陶瓷(釉)的制造过程中,采用不同的烧成气氛,氧化铁的呈色也各不相同,在氧化焰气氛下,氧化铁着色变以黄到红褐色,再以葡萄红色变为褐色。在还原气氛下,则呈现出蓝色到灰暗色变化,这些变化是釉层中Fe2+和Fe3+动态平衡相互转变的结果。精确称取试样约lg,加盐酸30ml,加热至不溶物接近呈白色。加水至50ml,过滤,用约50ml水洗涤残渣。合并洗液和滤液,加水至250m1。取此溶液25ml,浓缩至约10ml后,在加热的条件下加5%氯化亚锡溶液至混合液变为无色,再加l或2滴5%氯化亚锡后,立即冷却。加饱和氯化汞溶液10ml。再加25~30ml硫酸锰试液(TS-132)和约100ml水后,用0.1mol/L高锰酸钾滴定。按测定试样的相同方法做空白试验。每mI.0.1mol/L高锰酸钾相当于三价铁离子5.585mg。参见氧化铁红。三氧化二铁是铁锈的主要成分。铁锈的主要成因是铁金属在杂质碳的存在下,与环境中的水分和氧气反应,铁金属便会生锈。
(1)氧化铁与酸反应生成铁盐和水。
Fe2O3+6HCl=2FeCl3+3H2O
(2)铝热反应
铝与氧化铁混合后组成铝热剂,加热后生成氧化铝和铁。
2Al+Fe2O3=△=Al2O3+2Fe
(3)碳、一氧化碳还原性
氧化铁可以与碳混合后加热,铁和二氧化碳提取出来。
3C+2Fe2O3=高温=4Fe+3CO2↑
氧化铁可以和一氧化碳混合后加热,生成铁和二氧化碳。
3CO+Fe2O3=高温=2Fe+3CO2
(4)高温下三氧化二铁被CO、H2、Al、C、Si等还原。
Fe2O3+2Al=点燃=2Fe+Al2O3
Fe2O3+3CO=高温=2Fe+3CO2
2Fe2O3+3C=高温=4Fe+3CO2↑
2Fe2O3+3Si=高温=4Fe+3SiO2粉尘引起尘肺。空气中最高容许浓度,氧化铁气溶胶(烟尘)为5mg/m3。注意防尘。
由天然黄铁矿制得。
由硫酸亚铁或草酸铁经风化得硫酸铁,再经煅烧而得。
由氢氧化铁脱水而得。
制造硫酸、苯胺、氧化铝等过程中的副产物。
由碳酸铁、硝酸铁等经强热而得。
硫酸亚铁加热至650℃以上而得。
2α-FeOOH[△]→2α-FeSO3+H2O
湿法。
FeSO4+2NaOH→Fe(OH)2+Na2SO4
4Fe(OH)2+O2+2H2O→4Fe(OH)2↓
4FeSO4+4H2O+O2→2Fe2O3↓+4H2SO4
Fe+H2SO4→FeSO4+H2↑
将一定量的5%硫酸亚铁溶液迅速与过量氢氧化钠溶液反应(要求碱过量 0.04~0.08g/ml),在常温下通入空气,使之全部变为红棕色的氢氧化铁胶体溶液,作为沉积氧化铁的晶核。以上述晶核为载体,以硫酸亚铁为介质,通入空气,在75~85℃,在金属铁存以下,硫酸亚铁与空气中氧气作用生成三氧化二铁(即铁红)沉积在晶核上,溶液中的硫酸根又与金属铁作用重新生成硫酸亚铁,硫酸亚铁再被空气氧化成铁红继续沉积,这样循环至整个过程结束,生成氧化铁红。
干法。硝酸与铁屑反应生成硝酸亚铁,经冷却结晶、脱水干燥,经研磨后在600~700℃煅烧8~10h,在经水洗、干燥、粉碎制得氧化铁红产品。也可以氧化铁黄为原料,经600~700℃煅烧制得氧化铁红。
4Fe(NO3)→2Fe2O3+12NO2↑+3O2↑
Fe2O3·nH2O→Fe2O3+nH2O
湿法将一定量的5%硫酸亚铁溶液迅速与过量烧碱溶液反应(要求碱过量0.04~0.08 g/ml),在常温下通入空气使之全部变成红棕色的氢氧化铁胶体溶液,作为沉积氧化铁的晶核。以上述晶核为载体,以硫酸亚铁为介质,通入空气,在75~85℃,在金属铁存在的条件下,硫酸亚铁与空气中氧作用,生成三氧化二铁(即铁红)沉积在晶核上,溶液中的硫酸根又与金属铁作用,重新生成硫酸亚铁,硫酸亚铁再被空气氧化成铁红继续沉积,如此循环到整个过程结束,生成氧化铁红。其干法硝酸与铁片反应生成硝酸亚铁,经冷却结晶,脱水干燥,经研磨后在600~700℃煅烧8~10h,再经水洗、干燥、粉碎制得氧化铁红产品。也可以氧化铁黄为原料,经6()0~700℃煅烧制得氧化铁红。其
4Fe(NO3)3[△]→2Fe2O3+12NO2↑+3O2↑
Fe2O3+n H2O[△]→Fe2O3+nH2O

氧化铁颜料有着卓越的着色性能,在陶瓷中主要利用氧化铁的着色性,配制各种色彩的釉水,由于铁离子的价位不同,铁氧化物本身就呈现不同颜色。如:三氧化二铁(Fe2O3)为红色粉末,氧化亚铁(FeO)及四氧化三铁(Fe3O4)为黑色粉末。另外,在陶瓷(釉)的制造过程中,采用不同的烧成气氛,氧化铁的呈色也各不相同,在氧化焰气氛下,氧化铁着色变以黄到红褐色,再以葡萄红色变为褐色。在还原气氛下,则呈现出蓝色到灰暗色变化,这些变化是釉层中Fe2+和Fe3+动态平衡相互转变的结果。精确称取试样约lg,加盐酸30ml,加热至不溶物接近呈白色。加水至50ml,过滤,用约50ml水洗涤残渣。合并洗液和滤液,加水至250m1。取此溶液25ml,浓缩至约10ml后,在加热的条件下加5%氯化亚锡溶液至混合液变为无色,再加l或2滴5%氯化亚锡后,立即冷却。加饱和氯化汞溶液10ml。再加25~30ml硫酸锰试液(TS-132)和约100ml水后,用0.1mol/L高锰酸钾滴定。按测定试样的相同方法做空白试验。每mI.0.1mol/L高锰酸钾相当于三价铁离子5.585mg。参见氧化铁红。三氧化二铁是铁锈的主要成分。铁锈的主要成因是铁金属在杂质碳的存在下,与环境中的水分和氧气反应,铁金属便会生锈。
(1)氧化铁与酸反应生成铁盐和水。
Fe2O3+6HCl=2FeCl3+3H2O
(2)铝热反应
铝与氧化铁混合后组成铝热剂,加热后生成氧化铝和铁。
2Al+Fe2O3=△=Al2O3+2Fe
(3)碳、一氧化碳还原性
氧化铁可以与碳混合后加热,铁和二氧化碳提取出来。
3C+2Fe2O3=高温=4Fe+3CO2↑
氧化铁可以和一氧化碳混合后加热,生成铁和二氧化碳。
3CO+Fe2O3=高温=2Fe+3CO2
(4)高温下三氧化二铁被CO、H2、Al、C、Si等还原。
Fe2O3+2Al=点燃=2Fe+Al2O3
Fe2O3+3CO=高温=2Fe+3CO2
2Fe2O3+3C=高温=4Fe+3CO2↑
2Fe2O3+3Si=高温=4Fe+3SiO2粉尘引起尘肺。空气中最高容许浓度,氧化铁气溶胶(烟尘)为5mg/m3。注意防尘。
限用于非直接食用食品,用量不限(FDA,§186.1330,§186.1374,2000)。
FDA,§73.200.2000:限用于肠衣(成品量的0.10%)及猫狗食品(0.25%)。
GB 2760-96:糖果包衣0.02g/kg。 毒性 ADI 0~0.5mg/kg(FAO/WHO,2001)。
LD50>15g/kg(大鼠,经口)。
德国不准用。
化学性质
橙红至紫红色的三方晶系粉末。 不溶于水,溶于盐酸、硫酸,微溶于硝酸和醇。用途
用作防锈漆的颜料。因本品制成的云母氧化铁防锈漆抗水渗性好,防锈性能优异,可以取代红丹。用途
食用红色素。日本用于赤豆饭、魔芋粉食品。对曾用防腐剂处理果柄切口的香蕉加以识别时用。美国多用于猫食、狗食和包装材料。用途
用于电子工业、通讯整机、电视机、计算机等磁性原料及行输出变压器、开关电源及其高U及高UQ等的铁氧体磁芯用途
三氧化二铁被广泛用于油漆、橡胶、塑料、建筑等的着色,作为无机颜料,在涂料工业中也被用作防锈颜料。除此之外,它还被应用于橡胶、人造大理石、地面水磨石的着色剂,以及塑料、石棉、人造革、皮革揩光浆等的着色剂和填充剂。在精密仪器和光学玻璃中,它被用作抛光剂及制造磁性材料铁氧体元件的原料。在电子工业方面,它用于磁性原料、通讯整机、电视机、计算机等的铁氧体磁芯,以及行输出变压器、开关电源及其高U及高UQ等的铁氧体磁芯。此外,它还用作分析试剂、催化剂和颜料的配料,用于各类药片、药丸的外衣糖衣着色,以及磁性材料、颜料的制取还原剂、抛光剂、催化剂等。在食品工业中,它被用作食用红色素,在日本用于赤豆饭、魔芋粉食品,而在美国则多用于猫食、狗食和包装材料。此外,它还被用作硬币的透明着色和油墨的颜料,以及电讯、仪表工业中的分析试剂、催化剂、颜料配制等用途。用途
三氧化二铁是一种常用的无机红色颜料。在涂料工业中用作防锈颜料。广泛用于油漆、橡胶、塑料化妆品、建筑精磨材料、精密五金仪器、光学玻璃、搪瓷、文教用品、皮革、磁性合金和高级合金钢的着色。也用作分析试剂、人造大理石、地面水磨石的着色剂,塑料、石棉、人造革、皮革揩光浆等的着色剂和填充剂,精密仪器、光学玻璃的抛光剂及制造磁性材料铁氧体元件的原料等。生产方法
由天然黄铁矿制得。
由硫酸亚铁或草酸铁经风化得硫酸铁,再经煅烧而得。
由氢氧化铁脱水而得。
制造硫酸、苯胺、氧化铝等过程中的副产物。
由碳酸铁、硝酸铁等经强热而得。
硫酸亚铁加热至650℃以上而得。
生产方法
采用中和沉淀法。先制得氧化铁黑,再高温灼烧制得透明氧化铁线。将0.5mol/L浓度的FeCl3·6H2O溶液加热沸腾水解至红棕色胶粒出现为止(溶液1)。 取与溶液1等体积的0.25mol/L的FeCl2溶液(由金属铁与盐酸作用制得),用稀氨水调至白色沉淀不再消失为止(溶液2)。将溶液1和溶液2合并,搅拌,并加入适量的羟基羧酸络合剂和缓冲剂,维持恒温80℃。随反应的进行,不断有黑色Fe3O4生成。反应结束,将Fe3O4结晶转移至pH8、含有为Fe3O4质量比为10%~20%的油酸钠溶液中进行表面处理,搅拌悬浊液,恒温80℃,0.5h后将悬浊液用稀盐酸(1:3)调pH=6~6.5,将Fe3o4油酸吸附包覆物(黑色絮凝体)抽滤,热水搅洗数次,50~60℃真空烘干,制得疏松的粉体Fe3O4。将上述油酸包覆的Fe3O4慢速升温至550~600℃焙烧0.5h,得到均匀分散的透明铁红α-Fe2O3微粒子。生产方法
先制得透明氧化铁黄(制法参见透明氧化铁黄),经煅烧脱水,制得透明氧化铁红。其2α-FeOOH[△]→2α-FeSO3+H2O
生产方法
制备方法有湿法和干法。湿法制品结晶细小、颗粒柔软、较易研磨,易于作颜料。干法制品结晶大、颗粒坚硬,适宜作磁性材料、抛光研磨材料。湿法。
FeSO4+2NaOH→Fe(OH)2+Na2SO4
4Fe(OH)2+O2+2H2O→4Fe(OH)2↓
4FeSO4+4H2O+O2→2Fe2O3↓+4H2SO4
Fe+H2SO4→FeSO4+H2↑
将一定量的5%硫酸亚铁溶液迅速与过量氢氧化钠溶液反应(要求碱过量 0.04~0.08g/ml),在常温下通入空气,使之全部变为红棕色的氢氧化铁胶体溶液,作为沉积氧化铁的晶核。以上述晶核为载体,以硫酸亚铁为介质,通入空气,在75~85℃,在金属铁存以下,硫酸亚铁与空气中氧气作用生成三氧化二铁(即铁红)沉积在晶核上,溶液中的硫酸根又与金属铁作用重新生成硫酸亚铁,硫酸亚铁再被空气氧化成铁红继续沉积,这样循环至整个过程结束,生成氧化铁红。
干法。硝酸与铁屑反应生成硝酸亚铁,经冷却结晶、脱水干燥,经研磨后在600~700℃煅烧8~10h,在经水洗、干燥、粉碎制得氧化铁红产品。也可以氧化铁黄为原料,经600~700℃煅烧制得氧化铁红。
4Fe(NO3)→2Fe2O3+12NO2↑+3O2↑
Fe2O3·nH2O→Fe2O3+nH2O
生产方法
云母赤铁矿法云母赤铁矿石精选后,经湿球磨机磨成精矿粉,脱水,烘干,冷却,粉碎至325目,过筛,制成云母氧化铁。生产方法
制备方法有湿法和干法。湿法制品结晶细小、颗粒柔软、较易研磨,适宜作颜料。干法制品结晶大、颗粒坚硬,适宜作磁性材料、抛光研磨材料。湿法将一定量的5%硫酸亚铁溶液迅速与过量烧碱溶液反应(要求碱过量0.04~0.08 g/ml),在常温下通入空气使之全部变成红棕色的氢氧化铁胶体溶液,作为沉积氧化铁的晶核。以上述晶核为载体,以硫酸亚铁为介质,通入空气,在75~85℃,在金属铁存在的条件下,硫酸亚铁与空气中氧作用,生成三氧化二铁(即铁红)沉积在晶核上,溶液中的硫酸根又与金属铁作用,重新生成硫酸亚铁,硫酸亚铁再被空气氧化成铁红继续沉积,如此循环到整个过程结束,生成氧化铁红。其干法硝酸与铁片反应生成硝酸亚铁,经冷却结晶,脱水干燥,经研磨后在600~700℃煅烧8~10h,再经水洗、干燥、粉碎制得氧化铁红产品。也可以氧化铁黄为原料,经6()0~700℃煅烧制得氧化铁红。其
4Fe(NO3)3[△]→2Fe2O3+12NO2↑+3O2↑
Fe2O3+n H2O[△]→Fe2O3+nH2O
生产方法
硫酸亚铁氧化法将硫酸与铁屑反应制得硫酸亚铁,除砷及重金属,经氧化而得。流程参见氧化铁黄。安全信息
| 危险品标志 | Xi |
|---|---|
| 危险类别码 | 36/37/38 |
| 安全说明 | 26 |
| WGK Germany | - |
| RTECS号 | NO7400000 |
| TSCA | Yes |
| 海关编码 | 28211000 |
| 毒害物质数据 | 1309-37-1(Hazardous Substances Data) |
| 立即威胁生命和健康浓度 | 2,500 mg Fe/m3 |
