184429-84-3
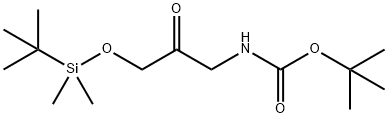 184429-84-3 结构式
184429-84-3 结构式
基本信息
3-(BOC-氨基)-1-[(叔丁基二甲基硅基)氧基]-2-丙酮
(3-((叔丁基二甲基硅烷基)氧基)-2-氧代丙基)氨基甲酸叔丁酯
N-[3-[3-[叔丁基(二甲基)甲硅烷基]氧基-2-氧丙基]氨基甲酸叔丁酯
叔-丁基 (3-((叔-丁基二甲基甲硅烷基)氧代)-2-氧亚基丙基)氨基甲酯
3-(Bc-Amino)-1-[(Tert-Butyldimethylsilyl)Oxy]-2-Propanone
3-(Boc-amino)-1-[(tert-butyldimethylsilyl)oxy]-2-propanone
tert-Butyl (3-((tert-butyldimethylsilyl)oxy)-2-oxopropyl)carbamate
Tert-Butyl N-(3-[(Tert-Butyldimethylsilyl)Oxy]-2-Oxopropyl)Carbamate
Carbamic acid, N-[3-[[(1,1-dimethylethyl)dimethylsilyl]oxy]-2-oxopropyl]-, 1,1-dimethylethyl ester
物理化学性质
制备方法
![3-(BOC-氨基)-1-[(叔丁基二甲基硅基)氧基]-2-丙醇](/CAS/GIF/195197-94-5.gif)
195197-94-5

184429-84-3
在氮气保护下,将草酰氯(13.6 mL,0.16 mol)溶解于无水二氯甲烷(150 mL)中,冷却至-78℃。在30分钟内缓慢滴加二甲基亚砜(15.2 mL,0.21 mol),滴加完毕后,于-78℃继续搅拌1小时。随后,在20分钟内滴加3-((叔丁基二甲基硅烷基)氧基)-2-羟丙基氨基甲酸叔丁酯(32.6 g,0.11 mol)的二氯甲烷(50 mL)溶液。反应混合物在-78℃下继续搅拌1小时后,加入三乙胺(59.6 mL,0.43 mol)。移除冷却浴,让反应混合物缓慢升温至室温。将反应混合物转移至分液漏斗中,加入水(100 mL)和二氯甲烷(70 mL)进行分配,水层用二氯甲烷(2×70 mL)进一步萃取。合并有机层,用无水硫酸钠干燥,氮气保护下浓缩。粗产物通过硅胶柱层析纯化,以5%乙酸乙酯的正己烷溶液为洗脱剂,得到3-((叔丁基二甲基硅烷基)氧基)-2-氧代丙基氨基甲酸叔丁酯(29.8 g,92%),为浅黄色油状物。1H-NMR(300 MHz,CDCl3)δ:0.11(6H,s),0.94(9H,s),1.47(9H,s),3.92(2H,s),4.26(2H,d,J=4.6 Hz),5.22(1H,br s)。
参考文献:
[1] Patent: WO2013/163675, 2013, A1. Location in patent: Paragraph 00182
[2] Canadian Journal of Chemistry, 1997, vol. 75, # 7, p. 942 - 948
[3] Journal of Medicinal Chemistry, 2006, vol. 49, # 3, p. 1191 - 1197
[4] Journal of Pharmacology and Experimental Therapeutics, 2013, vol. 347, # 2, p. 365 - 374