亜塩素酸ナトリウム 化学特性,用途語,生産方法
外観
無色澄明の液体
種類
亜塩素酸ナトリウムは、主に研究開発用試薬製品や工業用薬品として一般に販売されています。
1. 研究開発用試薬製品
実験室で取り扱いやすい容量での提供ですが、試薬製品としては比較的大容量で提供される安価な製品です。
不純物として炭酸ナトリウムを含む場合があります。通常、室温で保管可能な試薬製品として取り扱われます。主な想定用途は、有機合成化学などにおける酸化剤です。
2. 工業用薬品
工業用薬品としては、単一物質のほか、25%などの溶液でも販売されています。漂白剤や酸化剤としての用途のほか、化学原料としても用いられる製品です。
性質
亜塩素酸ナトリウムは、式量90.44であり、180-200℃で分解します。特異な刺激臭を持ち、常温での外観は、無色の吸湿性のある結晶です。密度は2.5g/mLであり、水によく溶けます (水への溶解度: 39g/100ml) 。
定義
本品は、次の化学式で表される無機化合物である。
解説
ClNaO2 (mw90.44).NaClO2.強い酸化力があり,漂白剤として用いられる.
朝倉書店 栄養・生化学辞典について 情報
用途
繊維、食品の漂白、抜洗剤、半導体表面処理剤
合成
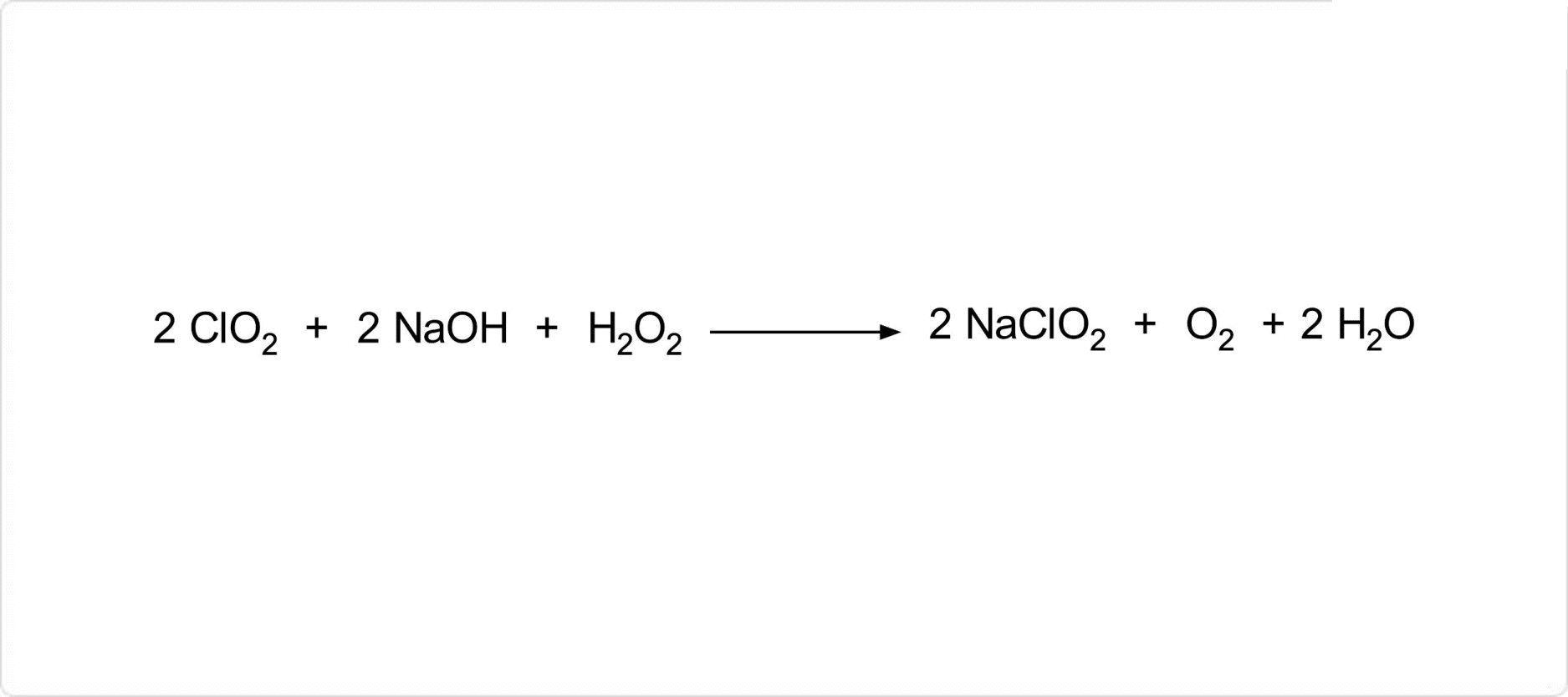
図1. 亜塩素酸ナトリウムの合成
亜塩素酸ナトリウムは、二酸化塩素に水酸化ナトリウムと過酸化水素とを反応させることによって合成されます。
化粧品の成分用途
口腔ケア剤、酸化剤
化学的特性
It is a white crystalline powder or flakes that is readily soluble in water. It is slightly hygroscopic.
使用
Sodium chlorite is used in the in situ generation of chlorine dioxide for stripping of textiles, bleaching, pulp and paper industries. It acts as a disinfectant in water treatment plant and as a preservative in eye drops. It is also used in contact lens cleaning solution and for sanitizing air ducts. It is associated with zinc chloride and used as a component in therapeutic rinses, toothpastes, mouth sprays and gels. It is utilized for the synthesis of 4-oxo-2-alkenoic acids from alkyl furans. Further, it is involved as a reagent in Pinnick oxidation reaction to prepare carboxylic acid from aldehydes.
定義
ChEBI: Sodium chlorite is an inorganic sodium salt in which chlorite is the counterion. It has a role as an oxidising agent. It is an inorganic sodium salt and a chlorite salt.
一般的な説明
Sodium chlorite appears as a white crystalline solid. Difficult to burn, but accelerates the burning of organic substances. Forms explosive mixtures with certain combustible materials. May explode under prolonged exposure to heat or fire. Used in water purification, to bleach wood pulp, textile, fats, oils; and for many other uses.
空気と水の反応
Soluble in water.
反応プロフィール
SODIUM CHLORITE SOLUTION is an oxidizing agent. Can react with acids to form spontaneously explosive chlorine dioxide gas (ClO2). Reacts with ammonia to produce ammonium chlorite, which is shock-sensitive. Finely divided metallic or organic substances in dry mixture with chlorites are highly flammable and may be ignited on friction (Lab. Gov. Chemist 1965). A mixture of organic matter and solid sodium chlorite can be extremely sensitive to heat, impact, or friction (Diox Process 1949). Sodium chlorite reacts very violently with organic materials containing divalent sulfur or with free sulfur (may ignite).
危険性
Flammable, strong oxidizing agent, dan-
gerous fire and moderate explosion risk. (Solution)
Strong irritant to skin and tissue.
健康ハザード
TOXIC; inhalation, ingestion or skin contact with material may cause severe injury or death. Contact with molten substance may cause severe burns to skin and eyes. Avoid any skin contact. Effects of contact or inhalation may be delayed. Fire may produce irritating, corrosive and/or toxic gases. Runoff from fire control or dilution water may be corrosive and/or toxic and cause pollution.
火災危険
Non-combustible, substance itself does not burn but may decompose upon heating to produce corrosive and/or toxic fumes. Some are oxidizers and may ignite combustibles (wood, paper, oil, clothing, etc.). Contact with metals may evolve flammable hydrogen gas. Containers may explode when heated.
使用用途
亜塩素酸ナトリウムの主な使用用途は、酸化剤、漂白剤です。パルプや綿、麻など様々な繊維の漂白や、和紙、油脂、ショ糖の脱色、プリント基板表面処理、脱硝処理、廃水処理などに用いられています。
日本国内では食品添加物 (漂白剤、殺菌料) として使用が認められている化合物です。ただし、健康被害が生じる可能性があるため、食品添加物として使用する場合は、最終食品の完成前に除去されなければならないと規定されています。その他の用途では、水処理工程における消毒剤や、コンタクトレンズの洗浄液などが挙げられます。
化学反応
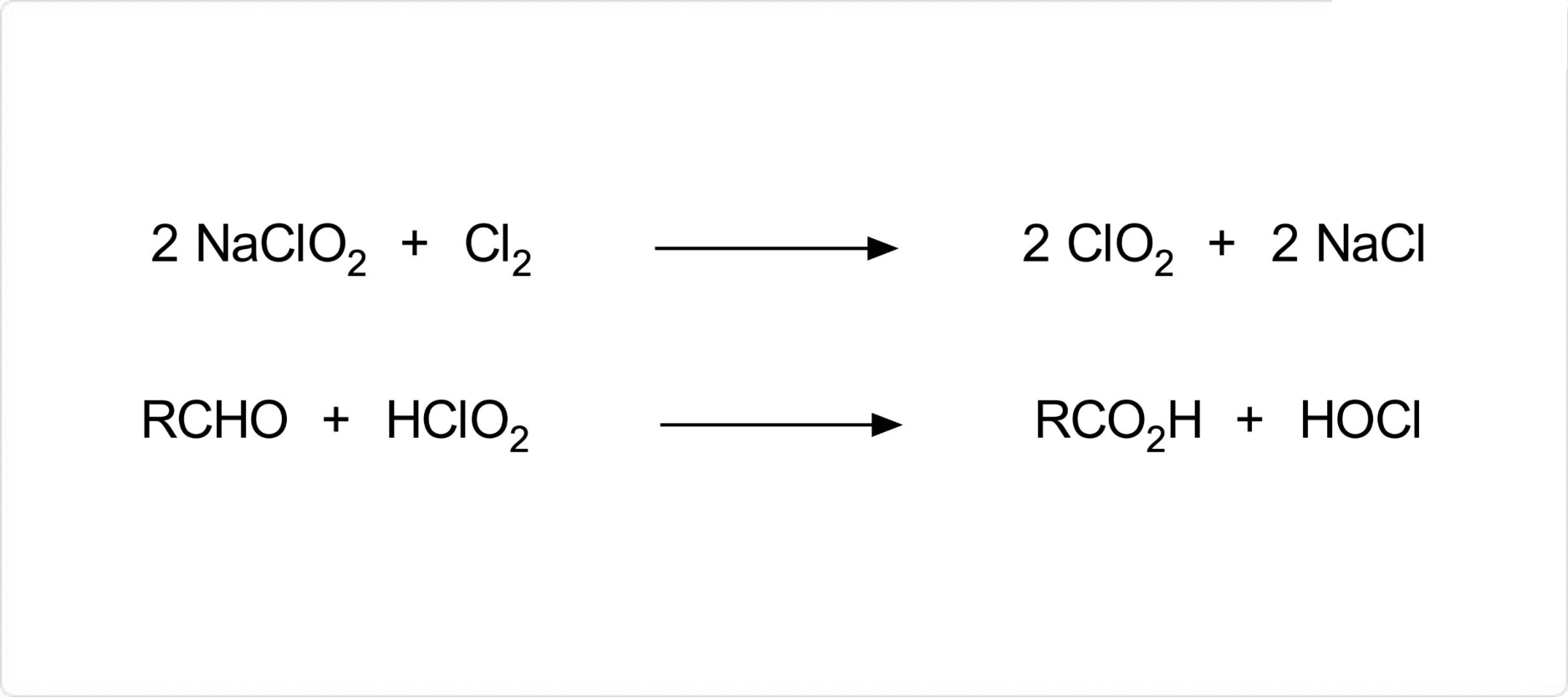
図2. 亜塩素酸ナトリウムの化学反応
亜塩素酸ナトリウムは、水溶液に塩素もしくは次亜塩素酸ナトリウムを作用させることにより、二酸化塩素が発生します。また、電気酸化、及び直射日光や紫外線による分解によっても二酸化塩素が発生します。加熱分解による生成物は、とです。
また、亜塩素酸ナトリウムは、有機合成化学において、亜塩素酸 (HClO2) を活性種として酸化反応に用いられます。具体的な反応の例としては、アルデヒドをカルボン酸へ変換する反応などです。
法規制情報
亜塩素酸ナトリウムは、以下のような有害性が指摘されています。また、強酸化性物質として、火災若しくは爆発の恐れがある化合物ともされます。
これらの危険性のため、亜塩素酸ナトリウムは、各種法令による規制を受ける物質です。毒物及び劇物取締法では劇物に指定されており、労働安全衛生法では「名称等を表示すべき危険物及び有害物」「名称等を通知すべき危険物及び有害物」に指定されています。
消防法においては、「第1類: 酸化性固体、亜塩素酸塩類、危険等級I、第一種酸化性固体」に分類される物質です。法令を遵守して正しく取り扱うことが求められます。
农业用途
Chlorite is a group of greenish clay minerals of variable composition (similar to mica in structure), which crystallizes in the monoclinic system. The term chlorite is derived from 'chloros', the Greek word for green.
Chlorites are composed of complex silicates of aluminum, magnesium and iron in combination with water.
These are often called 2:2 type clays because they are similar to the unit lattice of vermiculite. But strictly speaking, they are 2:1:1 type clays. A layer of chlorite has 2 silicate tetrahedral units, one alumina octahedral unit and one magnesium octahedral sheet. It has a low cation exchange capacity. Chlorites are most commonly found in low-grade metamorphic rocks. They also occur as secondary minerals in igneous rocks as alteration products of pyroxenes, amphiboles and micas.
Chlorites are infrequent in soils and when present, make up a small fraction of clay minerals. Chlorites are primary minerals and form vermiculites and smectites. Chlorites do not swell on wetting.
安全性プロファイル
Poison by ingestion. An experimental teratogen. Experimental reproductive effects. Questionable carcinogen with experimental carcinogenic data. Mutation data reported. May act as an irritant due to its oxidizing power. A powerful oxidzing agent; ignited by friction, heat, or shock. An explosive sensitive to impact or heating to 200'. Potentially explosive reaction with acids, oils, organic matter, oxahc acid + water, zinc. Violent reaction or iption with carbon (above 60'), ethylene glycol (at loo'), phosphorus (above SO0), sodum dithionate, sulfur-containing materials. Can react vigorously on contact with reducing materials. When heated to decomposition it emits highly toxic fumes of Cland NazO. Used as a bleachmg agent. See also CHLORITES.
純化方法
Crystallise the chlorite from hot water and store it in a cool place. It has also been crystallised from MeOH by counter-current extraction with liquid ammonia [Curti & Locchi Anal Chem 29 534 1957]. A major impurity is chloride ion which can be removed by recrystallisation from 0.001M NaOH. [Schmeisser in Handbook of Preparative Inorganic Chemistry (Ed. Brauer) Academic Press Vol I p 312 1963.]
亜塩素酸ナトリウム 上流と下流の製品情報
原材料
準備製品