亜ひ酸 化学特性,用途語,生産方法
種類
三酸化ヒ素は、主に研究開発用試薬製品として販売されています。容量の種類には、10g、25g、50g、100g、250g、1kgなどの種類があり、実験室で取り扱いやすい容量での提供です。室温で保管可能な試薬製品として扱われます。
毒物及び劇物取締法における毒物であるため、購入・保管には所定の手続きが必要です。
性質
三酸化ヒ素は、分子量197.841、融点312.2℃、沸点465℃であり、常温常圧において無色無臭の固体です。昇華性があるため、強く加熱すると酸化ヒ素 (III) のガスを発生します。このガスは強い溶血作用を持つ性質があります。
密度は3.74g/mL、水への溶解度は20g/L (25°C)です。アルコール、クロロホルム、エーテルに溶けず、グリセリンに溶解します。水に溶かすと水和して亜ヒ酸 (As(OH)3) となり、弱酸性を示します。酸解離定数pKaは、9.2です。
解説
三酸化二ヒ素As2O3を水に溶かしたときに存在すると考えられる酸。化学式H3AsO3,HAsO2などであらわされるが,遊離状態では得られていない。弱酸であるが両性を示し,塩基としても働く。酸解離定数Ka=6×10-6(HAsO2⇄H++AsO2-),塩基解離定数Kb=10-14(AsO(OH)⇄AsO++OH-)。中性および微酸性水溶液は安定であるが,アルカリ性水溶液では空気により酸化されてヒ酸となりやすい。
株式会社平凡社 世界大百科事典 第2版について 情報
用途
ガラス
合成
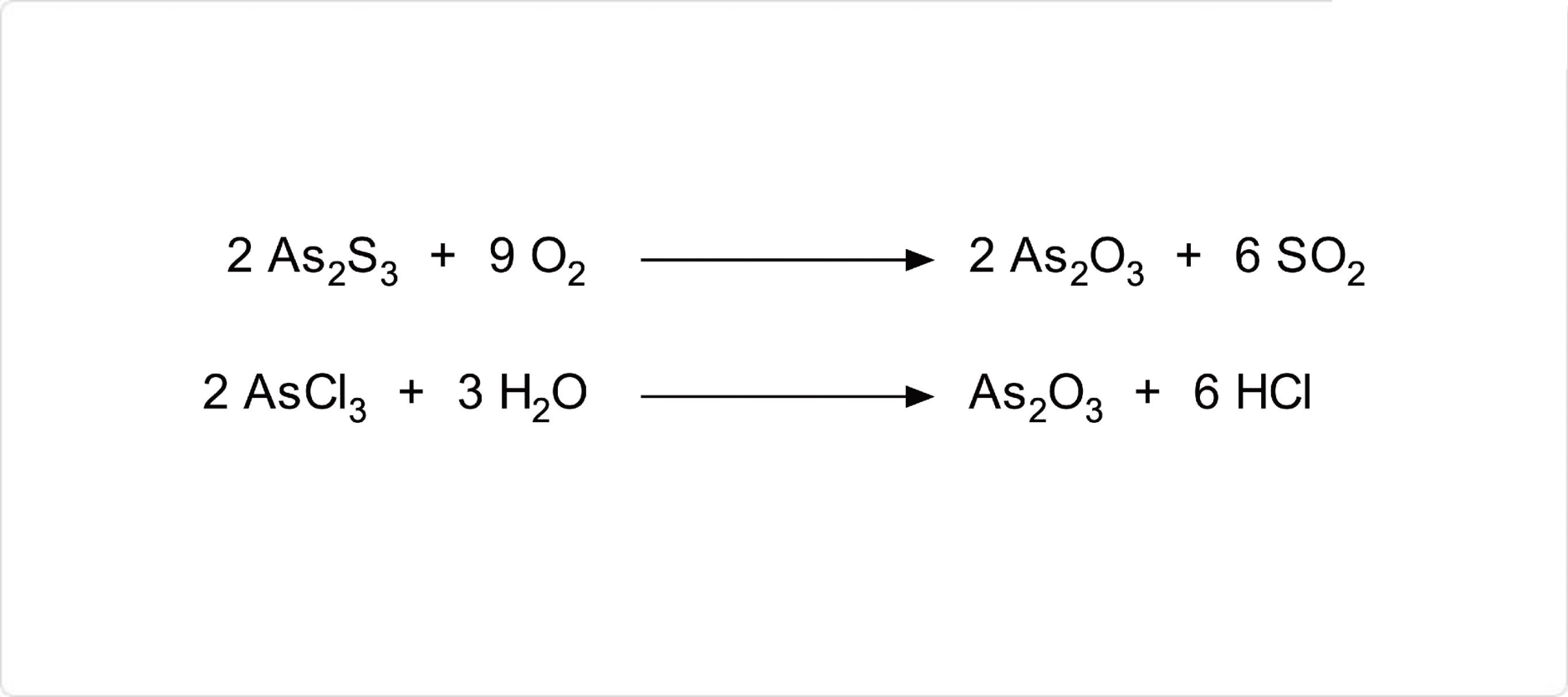
図2. 三酸化ヒ素の合成
三酸化ヒ素は、硫化ヒ素を空気中で加熱する酸化反応によって得ることができます。実験室的製法では、三塩化ヒ素の加水分解によって得ることが可能です。
説明
Arsenic trioxide, often denoted as As
2O
3 butmore correctly stated as As
4O
6, is an inorganic compound mainly
used as the precursor for organoarsenic compounds. It can be obtained by the oxidation of arsenic-containing
minerals in the air, such as roasting of orpiment.
2As
2S
3 + 9O
2 → As
4O
6 + 6SO
2
化学的特性
WHITE POWDER AND FINE CHUNKS
使用
It is a reductometric standard.
定義
A colorless crystalline solid that is very poisonous (0.1 g would be a lethal dose). Analysis of the solid and vapor states suggests a dimerized structure of As
4O
6. An amphoteric oxide, arsenic(III) oxide is sparingly soluble in water, producing an acidic solution. It is formed when arsenic is burned in air or oxygen.
製造方法
Arsenic trioxide is obtained by roasting the mineral arsenopyrite, FeAsS, in air at 650 to 700°C. It is also obtained as a by-product during the smelting ofcopper and lead concentrates during the extraction of these metals from their ores that contain arsenic. The latter readily oxidizes to arsenic trioxide which is volatilized. The vapors are then condensed and collected. High purity-grade oxide can be obtained by resublimation of the crude trioxide or by pressure leaching and recrystallization. Arsenic trioxide may also be prepared by hydrolysis of arsenic trichloride, -tribromide or -trifluoride.
反応性
In the processing of As2O3 the oxide is normally reduced withcarbon:
2As2O3+3C?→As4+3CO2
The reaction is endothermic and is carried out at 500–800℃.The elemental arsenic sublimes and is condensed out of the reaction gas by cooling.
一般的な説明
White or transparent, glassy amorphous lumps or crystalline powder. Slightly soluble in water, but dissolves very slowly; more soluble in hot water. Noncombustible. Corrosive to metals in the presence of moisture. Toxic by ingestion.
空気と水の反応
Slightly soluble in water, but dissolves very slowly; more soluble in hot water [Merck].
反応プロフィール
Arsenic(III) oxide reacts vigorously with fluorine at ordinary temperatures [Mellor 9:34 1946-47]. Dissolves in aqueous acids. Incompatible with tannic acid, infusions of cinchona and other vegetable astringent infusions and decoctions, and with iron in solution [Merck].
危険性
A confirmed carcinogen.
健康ハザード
Material is considered super toxic; probable oral lethal dose (human) is less than 5 mg/kg, i.e., a taste (less than 7 drops) for a 70kg (150 lb.) person. Material causes acute gastrointestinal and central nervous system symptoms. Renal and hepatic damage have also been observed. Chronic exposure to material has led to nasal septum perforation, dermatological symptoms (lesions, necrosis, etc.) and an increase in the incidence of lung and lymphatic cancers. Appreciable exposure to respiratory irritant promoters such as metal oxide fumes elicits a carcinogenic response from Arsenic(III) oxide .
火災危険
Toxic fumes of Arsenic(III) oxide and arsine may be formed in fire situations. Contact with halide acids will form toxic volatile halides. Reduction in acid solutions will form arsine. Arsenic(III) oxide and excess zinc filings will explode on heating. Avoid sodium chlorate; fluorine; chlorine trifluoride; chromic oxide; aluminum chloride; phosphorus pentoxide; hydrogen fluoride; oxygen difluoride, tannic acid; infusion cinchona and other vegetable astringent infusions and decoctions; iron in solution. Arsenic(III) oxide is stable in air but slowly oxidizes in acid media.
有害性
三酸化ヒ素は、非常に毒性の強い化合物です。GHS 分類では、「急性毒性 (経口) : 区分2」「 眼に対する重篤な損傷・眼刺激性: 区分2A-2B」「生殖細胞変異原性: 区分2」「発がん性: 区分1A」「生殖毒性: 区分1A」などに分類されています。
具体的な危険としては、下記のものが挙げられます。
- 飲み込むと生命に危険
- 強い眼刺激
- 遺伝性疾患のおそれの疑い
- 発がんのおそれ
- 生殖能又は胎児への悪影響のおそれ
- 消化管、心臓、骨格筋、呼吸器の障害
- 長期又は反復ばく露による中枢神経系、末梢神経系、免疫系、呼吸器、肝臓、腎臓、皮膚、血管の障害
法規制情報
三酸化ヒ素は前述の有害性により、毒物及び劇物取締法で毒物に指定されている物質です。それ以外にも、労働安全衛生法では、名称等を表示すべき危険有害物、及び、名称等を通知すべき有害物質、リスクアセスメントを実施すべき危険有害物、特定化学物質第2類物質、管理第2類物質、 特定化学物質特別管理物質に指定されています。
PRTR法では、第一種指定化学物質に指定されています。法令を遵守して正しく取り扱うことが厳しく求められる化合物です。
参考文献
使用用途
三酸化ヒ素は非常に強い毒性を持つため、殺鼠剤、殺虫剤や、農薬として使用されてきた歴史があります。虫歯や白血病治療薬にも用いられてきましたが、副作用として慢性ヒ素中毒やガンにかかることが多く、近年では使用が減少しつつあります。
工業的には金属ヒ素やヒ素化合物を製造する際の原料として用いられる物質です。その他には、触媒、ガラスの脱色、脱硫剤、顔料、染料製造、媒染剤、魚網・皮革の防腐剤、散弾用鉛の硬化剤、半導体製造におけるドーピングや、結晶育成原料などの用途を挙げることができます。
化学反応
三酸化ヒ素は、両性酸化物であり、酸とも塩基とも反応します。また、フッ化水素や塩化水素と反応して、それぞれフッ化ヒ素や塩化ヒ素を与えます。オゾン、過酸化水素、硝酸などの強い酸化剤によって酸化され、この反応の生成物はヒ酸もしくは五酸化二ヒ素です。
安全性プロファイル
Confirmed human
carcinogen with experimental neoplastigenic
and tumorigenic data. Poison by ingestion,
subcutaneous, and intravenous routes.
Human systemic effects by ingestion: sleep
changes, muscle weakness, hypermotiltty,
darrhea, cardiac arrhythmias, coma, fatty
degeneration of the liver, depressed renal
function tests. An experimental teratogen.
Other experimental reproductive effects.
Mutation data reported. Reacts vigorously
with Rb2C2, CIF3, F2, Hg, OF2, NaClO3. See
also ARSENIC COMPOUNDS.
職業ばく露
Arsenic trioxide, a primary raw material
for other arsenic compounds, is used in manufacture of
pesticides, glass, industrial chemicals, and drugs. It is an
intermediate for insecticides, herbicides and fungicides.
The material is used as a wood and tanning preservative
and a decoloring and refining agent in glass manufacture. It
is also used in pharmaceuticals and in the purification of
synthetic gas.
輸送方法
UN1561 Arsenic trioxide, Hazard Class: 6.1;
Labels: 6.1-Poisonous materials
純化方法
It crystallises in an octahedral form (common form) from H2O or from dilute HCl (1:2), and is then washed, dried and sublimed (193o/760mm). Analytical reagent grade material is suitable for use as an analytical standard after it has been dried at 105o for 1-2hours or has been left in a desiccator for several hours over conc H2SO4. Alternatively: As2O3 (15g) is dissolved by heating in a mixture of H2O (60mL) and HCl (90g, s.g. 1.1), and crystallisation occurs on cooling, accompanied by brilliant flashes of light [Bandrowski Z Phys Chem 17 234 1895]. The amorphous form is a colourless transparent glass (m 200o) which is obtained when the vapour is slowly condensed below the vaporization temperature, and should be kept in a sealed tube because it changes to the octahedral form (m 275o) in the presence of moisture. [Rushton & Daniels J Am Chem Soc 48 384 1926.] A third monoclinic form, is obtained by heating the oxide in a sealed tube at 400o (the vitreous, amorphous form remains at the bottom of the tube) with the monoclinic form subliming onto the intermediate part of the tube at 200o (m 312o), and the octahedral form deposits at the top of the tube. The transition temperature between the last two forms is ~250o. POISONOUS (particularly the vapour, handle in a ventilated fume cupboard). [Schenk in Handbook of Preparative Inorganic Chemistry (Ed. Brauer) Academic Press Vol I p 600 1963.]
不和合性
Sodium chlorate; sodium hydroxide, sulfuric
acid; fluorine; chlorine trifluoride; chromic oxide; aluminum
chloride; phosphorus pentoxide; hydrogen fluoride;
oxygen difluoride; tannic acid; infusion cinchona and other
vegetable astringent infusions and decoctions; iron in solution.
Contact with acids or acid mists releases deadly arsine
gas.
廃棄物の処理
Consult with environmental
regulatory agencies for guidance on acceptable disposal
practices. Generators of waste containing this contaminant
(≥100 kg/mo) must conform with EPA regulations governing
storage, transportation, treatment, and waste disposal.
Dissolve in a minimum of concentrated hydrochloric acid.
Dilute with water until white precipitate forms. Add HCl to
dissolve. Saturate with H2S; filter and wash precipitate and
return to supplier. Alternatively, precipitate with heavy
metals, such as lime or ferric hydroxide in lieu of H2S.
If needed, seek professional environmental engineering
assistance from the United States Environmental Protection
Agency Environmental Response Team at (908) 548-8730
(24-hour response line).
亜ひ酸 上流と下流の製品情報
原材料
準備製品