D-氨基酰化酶
D-氨基酰化酶 性质
d-氨基酰化酶也称为N-酰基-D-氨基酸酰胺水解酶(3.5.1.81),它催化水解D-氨基酸的酰化衍生物得D-氨基酸,是分离消旋DL-氨基酸的一类重要水解酶类。D-氨基酸已成为制备半合成抗生素、药物、杀虫剂、生物活性多肽和食品添加剂等的关键中间体,其开发利用成为氨基酸产业的一个新热点。D-氨基酰化酶均具有高的光学选择性和广泛的底物特异性。早在1952年Kameda等首次在假单胞菌KT83中发现了D-氨基酰化酶,1978年又在另一株假单胞菌中发现了D-氨基酰化酶(Yukioet al., 1978)。Sugie和Suzuki (1978)在1978年也报道了产D-氨基酰化酶的Streptomyces olivaceus。经过60余年的努力,至今已在 Pseudomonas (Kubo et al., 1980; Sakaietal., 1991)、链霉菌(Tokuyama and Matsuyama,2003; Arima et al., 2013)、 Alcaligenes (Yang et al.,1991; Wakayama et al., 1996; Liaw et al., 2003)、Variovoras (Lin et al., 2002)、寄生菌(Matsuyama et al.,2002)、Stenotrophomonas (Muniz-Lozano etal., 1998)、短小芽孢杆菌(Baek et al., 2003)、Defluvibacter (Kumagai et al., 2004)、Trichoderma (Wakayama et al., 2004)、Sebekia (Tokuyama, 1999)、Amycolatopsis (Tokuyama,2000)和 无色杆菌(Wang et al., 2013) 等不同种属微生物中发现了D-氨基酰化酶的存在。根据底物特异性可将D-氨基酰化酶分为三类:催化中性氨基酸N- 酰基衍生物水解的D-氨基酸酰化酶(D-ANase) 、专一性水解N-酰基 -D-谷氨酸的N-酰基-谷氨酸-酰胺水解酶(D-AGase)、专一性水解N-酰基-D-天冬氨酸的N-酰基-天冬氨酸-酰胺水解酶(D-AAase)。目前所发现 D-氨基酰化酶大多偏好于水解N-酰基中性氨基酸,但Sakai等发现了能够同时产D-谷氨酸氨基酰化酶和D-天冬氨酸氨基酰化酶的菌株Alcaligenes . xylo-soxydans ssp. xylosoxyda A-6。2013年,Wang等首次报道了A. xylosoxidans ssp. denitrificans ATCC15173菌株中含有能同时作用于N-酰基中性氨基酸和N-酰基-D-天冬氨酸的D-氨基酰化酶。尽管大多数D-氨基酰化酶来源于微生物,但不同微生物源D-氨基酰化酶的分子量、等电点、最适反应温度和pH、诱导剂、抑制剂、底物特异性等都会有不同程度的差异。如 Pseudomonas sp. 1158 和 B.borstelensis BCS-1 D-氨基酰化酶的分子量明显比来源于其它菌株的 D-氨基酰化酶的分子量大许多;B. borstelensis BCS-1相比其它菌株更耐高温和碱性环境;从诱导剂而言,Trichoderma sp. SKW-36菌株不同于其它菌株,其所产生的D-氨基酰化酶为组成酶,不需要诱导剂。 当然不同来源的氨基酰化酶之间也有相似之处:如分子量大多在50 kD左右,最适温度在50℃左右,最适pH偏弱碱性,最佳底物多为N-Ac-D-Met,活性基本能被Zn2+、Hg2+和Cu2+抑制。不同来源D-氨基酰化酶的性质如图1所示。
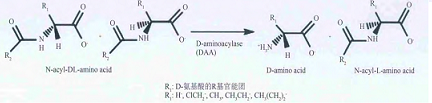
D-氨基酰化酶的水解作用D-氨基酰化酶属于α/β-桶氨基酰化酶大家族,该家族酶一般分为两类:(1)包含双核的脲酶、磷酸三酯酶、磷酸三酯酶同源蛋白、二氢乳清酸酶和二氢嘧啶酶;(2)包含单核的腺苷脱氨酶和胞嘧啶脱氨酶。D-氨基酰化酶以不同的亲和力与两个锌离子结合,一个锌离子紧密结合到β位,被Cys96、His220和His250螯合;另一个锌离子松弛地结合到α位上,被His67、His69、Asp366和醋酸分子(ACT1)所围绕。只有紧密结合的锌离子对酶的催化作用有效果。并且外在的锌离子不会增强酶的活性,过量的锌离子甚至会严重抑制酶的活性。 所以D-氨基酰化酶是一种单核酶,但具有双核活性位点,故D-氨基酰化酶是α/β-桶氨基酰化酶大家族中的β-桶类。尽管目前已有多个D-氨基酰化酶被成功克隆和表达,但关于D-氨基酰化酶的晶体结构研究较少,仅有A. facelis DA1的D-氨基酰化酶的晶体结构被解析,其立体结构如图2所示:该酶由483个氨基酸组成,上部为一个负责结构稳定的小β-桶(7~61和425~480残基),中间是一个负责催化功能的α/β-桶(62~414残基),底部是一个负责调节底物和酶结合中间体构象转变的插入部分(285~347残基)。
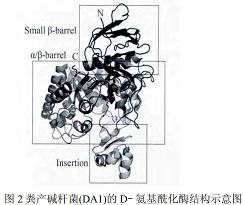
粪产碱杆菌(DA1)的D-氨基酰化酶结构示意图α/β-桶氨基酰化酶家族高度的结构同源性同样反映在它们的催化机理上,特别是在水解反应中的亲核进攻非常相似。α金属离子通过降低其pKa值来激活水分子,β金属离子作为一种亲核催化剂使羰基氧原子极化结合底物。高度保守的Asp366作为一种广义碱激活亲核试剂水分子:与Asp366氧原子近距离的His67氮源子可以提取质子,与ACT1氧原子,Asp366氧原子近距离的His69氮源子能更进一步地激活已经电离的水分子,同时维持带电中间体的稳定。
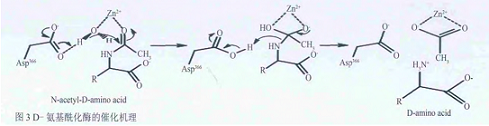
D-氨基酰化酶的晶体结构与模式底物提供了基于结构基础的酶催化机理。从图3中可以发现:Asp366 的羧基首先捕获水分子的一个质子,产生一个具有亲核性的-OH,进攻被Zn2+极化的羰基碳,碳氧双键断裂成单键且氧带负电,形成一个中间体。接着带负电的氧进行分子内进攻重新形成碳氧双键,酰胺键断裂,同时带负电的氨基氮捕获Asp366羧基上的质子,酶分子复原,同时得到产物D-氨基酸和乙酸锌。N-乙酰-L-蛋氨酸也可以进入活性位点,但L-型异构体在底物酰胺和Ser289的羰基之间没有相互作用,可能是酰胺碳原子缺少水分子进攻的合适方向。所以相对于D-型底物而言,L-型底物的水解效率只有D-型的1/100。
D-氨基酰化酶的催化机理D-氨基酰化酶广泛用于拆分D,L-氨基酸制备D-氨基酸。如Matsuyama 等以N-乙酰-D-色氨酸为底物,利用来源于H. mycophilus的D-氨基酰化酶生产D-色氨酸。Kumagai等利用来源于Defluvibactersp. A131-3的D-氨基酰化酶水解N-乙酰-D,L-丙氨酸制备D-丙氨酸。近几年有学者报道D-氨基酰化酶除了能够选择性拆分D, L-氨基酸外,还能够催化迈克尔加成反应,如Wang等利用 D-氨基酰化酶在有机溶剂中催化嘌呤衍生物迈克尔加成制备α,β不饱和羰基化合物,对溶剂、温度、酶浓度等影响迈克尔加成反应的因素进行了系统的研究,并成功制备了21种迈克尔加成产物。2013年他们又通过双迈克尔加成合成杂螺[5, 5]十一烷等(图4),这是目前首次有文献报道利用水解酶催化迈克尔双加成反应。

D-氨基酰化酶催化的迈克尔加成反应

D-氨基酰化酶的水解作用D-氨基酰化酶属于α/β-桶氨基酰化酶大家族,该家族酶一般分为两类:(1)包含双核的脲酶、磷酸三酯酶、磷酸三酯酶同源蛋白、二氢乳清酸酶和二氢嘧啶酶;(2)包含单核的腺苷脱氨酶和胞嘧啶脱氨酶。D-氨基酰化酶以不同的亲和力与两个锌离子结合,一个锌离子紧密结合到β位,被Cys96、His220和His250螯合;另一个锌离子松弛地结合到α位上,被His67、His69、Asp366和醋酸分子(ACT1)所围绕。只有紧密结合的锌离子对酶的催化作用有效果。并且外在的锌离子不会增强酶的活性,过量的锌离子甚至会严重抑制酶的活性。 所以D-氨基酰化酶是一种单核酶,但具有双核活性位点,故D-氨基酰化酶是α/β-桶氨基酰化酶大家族中的β-桶类。尽管目前已有多个D-氨基酰化酶被成功克隆和表达,但关于D-氨基酰化酶的晶体结构研究较少,仅有A. facelis DA1的D-氨基酰化酶的晶体结构被解析,其立体结构如图2所示:该酶由483个氨基酸组成,上部为一个负责结构稳定的小β-桶(7~61和425~480残基),中间是一个负责催化功能的α/β-桶(62~414残基),底部是一个负责调节底物和酶结合中间体构象转变的插入部分(285~347残基)。

粪产碱杆菌(DA1)的D-氨基酰化酶结构示意图α/β-桶氨基酰化酶家族高度的结构同源性同样反映在它们的催化机理上,特别是在水解反应中的亲核进攻非常相似。α金属离子通过降低其pKa值来激活水分子,β金属离子作为一种亲核催化剂使羰基氧原子极化结合底物。高度保守的Asp366作为一种广义碱激活亲核试剂水分子:与Asp366氧原子近距离的His67氮源子可以提取质子,与ACT1氧原子,Asp366氧原子近距离的His69氮源子能更进一步地激活已经电离的水分子,同时维持带电中间体的稳定。
D-氨基酰化酶的晶体结构与模式底物提供了基于结构基础的酶催化机理。从图3中可以发现:Asp366 的羧基首先捕获水分子的一个质子,产生一个具有亲核性的-OH,进攻被Zn2+极化的羰基碳,碳氧双键断裂成单键且氧带负电,形成一个中间体。接着带负电的氧进行分子内进攻重新形成碳氧双键,酰胺键断裂,同时带负电的氨基氮捕获Asp366羧基上的质子,酶分子复原,同时得到产物D-氨基酸和乙酸锌。N-乙酰-L-蛋氨酸也可以进入活性位点,但L-型异构体在底物酰胺和Ser289的羰基之间没有相互作用,可能是酰胺碳原子缺少水分子进攻的合适方向。所以相对于D-型底物而言,L-型底物的水解效率只有D-型的1/100。

D-氨基酰化酶的催化机理D-氨基酰化酶广泛用于拆分D,L-氨基酸制备D-氨基酸。如Matsuyama 等以N-乙酰-D-色氨酸为底物,利用来源于H. mycophilus的D-氨基酰化酶生产D-色氨酸。Kumagai等利用来源于Defluvibactersp. A131-3的D-氨基酰化酶水解N-乙酰-D,L-丙氨酸制备D-丙氨酸。近几年有学者报道D-氨基酰化酶除了能够选择性拆分D, L-氨基酸外,还能够催化迈克尔加成反应,如Wang等利用 D-氨基酰化酶在有机溶剂中催化嘌呤衍生物迈克尔加成制备α,β不饱和羰基化合物,对溶剂、温度、酶浓度等影响迈克尔加成反应的因素进行了系统的研究,并成功制备了21种迈克尔加成产物。2013年他们又通过双迈克尔加成合成杂螺[5, 5]十一烷等(图4),这是目前首次有文献报道利用水解酶催化迈克尔双加成反应。

D-氨基酰化酶催化的迈克尔加成反应
