


化合物简介
化学式:C22H22N6O7S2
分子量:546.576
PSA:244.76000
CAS号:72558-82-8
EINECS:276-715-9
外观:无色结晶或白色粉末
药典标准
基本信息
本品为(6R,7R)-7-[[(2-氨基-4-嚷唑基)-[(1-羧基-1-甲基乙氧基)亚氨基]乙酰基]氨基]-2-羧基-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-3-甲基吡啶鎓内盐五水合物。按干燥品计算,含头孢他啶(按C22H22N6O7S2)不得少于95.0%。
性状
本品为白色或类白色结晶性粉末,无臭或微有特臭。
本品在水或甲醇中微溶,在丙酮中不溶,在磷酸盐缓冲液(pH6.0)中略溶。
吸收系数
取本品,精密称定,加磷酸盐缓冲液(pH6.0)溶解并定量稀释制成每1mL中约含10μg的溶液,照紫外-可见分光光度法(通则0401),在257nm的波长处测定吸光度,吸收系数(E1%1cm)为400~430。
鉴别
1、在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
2、本品的红外光吸收图谱应与对照的图谱(光谱集718图)一致。
检查
酸度
取本品,加水制成每1mL中含5.0mg的溶液,依法测定(通则0631),pH值应为3.0~4.0。
溶液的澄清度与颜色
取本品5份,各0.6g,分别加碳酸钠溶液(1→100)5mL使溶解,溶液应澄清无色;如显浑浊,与1号浊度标准液(通则0902第一法)比较,均不得更浓,如显色,与黄色或黄绿色6号标准比色液(通则0901第一法)比较,均不得更深。
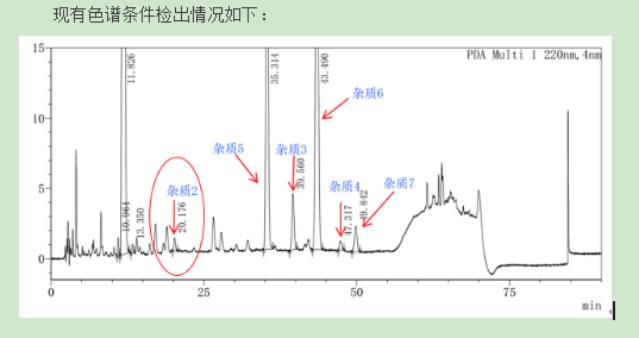
有关物质
照高效液相色谱法(通则0512)测定,临用新制。
供试品溶液:取本品,加流动相A-流动相B(7:93)溶解并稀释制成每1mL中约含1.2mg的溶液。
对照溶液:精密量取供试品溶液1mL,置100mL量瓶中,用流动相A-流动相B(7:93)稀释至刻度,摇匀。
系统适用性溶液:取头孢他啶对照品60mg,置50mL量瓶中,加0.1mol/L盐酸溶液5mL溶解,用水稀释至刻度,摇匀。在沸水浴中放置20分钟,取出,放冷。
色谱条件:用十八烷基硅烷键合硅胶为填充剂,流动相A为乙腈,流动相B为磷酸盐缓冲溶液(取磷酸二氢铵22.6g加水溶解并稀释至1000mL,用10%的磷酸溶液调节pH值至3.9),按下表进行线性梯度洗脱,柱温为35℃,检测波长为255nm;,进样体积为20μL。
保留时间(分钟)
流动相A(%)
流动相B(%)
0
7
93
14
7
93
29
14
86
40
14
86
41
7
93
52
7
93
系统适用性要求:系统适用性溶液色谱图中,头孢他啶峰与其前相邻杂质峰之间的分离度应符合要求。
测定法:精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
限度:供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积的0.5倍(0.5%),各杂质峰面积的和不得大于对照溶液主峰面积的2倍(2.0%),小于对照溶液主峰面积0.05倍的峰忽略不计。
头孢他啶聚合物
照分子排阻色谱法(通则0514)测定,临用新制。
供试品溶液:精密称取本品约0.2g与碳酸钠20mg,置10mL量瓶中,加水适量使溶解后,用水稀释至刻度,摇匀。
对照溶液:取头孢他啶对照品适量,精密称定,加水溶解并定量稀释制成每1mL中约含0.1mg的溶液。
系统适用性溶液(1):取蓝色葡聚糖2000适量,加水溶解并稀释制成每1mL中约含1.5mg的溶液。
系统适用性溶液(2):取头孢他啶约0.2g与碳酸钠20mg,置10mL量瓶中,加系统适用性溶液(1)溶解并稀释至刻度,摇匀。
色谱条件:用葡聚糖凝胶G-10(40~120µm)为填充剂,玻璃柱内径1.0~1.4cm,柱长45cm,以含3.5%硫酸铵的pH7.0的0.1mol/L磷酸盐缓冲液[0.1mol/L磷酸氢二钠溶液-0.1mol/L磷酸二氢钠溶液(61:39)]为流动相A,以水为流动相B,流速为每分钟0.8mL,检测波长为254nm,进样体积100-200µL。
系统适用性要求:系统适用性溶液(1)分别在以流动相A与流动相B为流动相记录的色谱图中,按蓝色葡聚糖2000峰计算,理论板数均不低于500,拖尾因子均应小于2.0,蓝色葡聚糖2000的保留时间比值应在0.93~1.07之间。系统适用性溶液(2)在以流动相A为流动相记录的色谱图中,高聚体的峰高与单体和高聚体之间的谷高比应大于1.5。对照溶液色谱图中主峰与供试品溶液色谱图中聚合物峰与相应色谱系统中蓝色葡聚糖2000的保留时间的比值均应在0.93~1.07之间。以流动相B为流动相,精密量取对照溶液连续进样5次,峰面积的相对标准偏差应不大于5.0%。
测定法:以流动相A为流动相,精密量取供试品溶液注入液相色谱仪,记录色谱图,以流动相B为流动相,精密量取对照溶液注入液相色谱仪,记录色谱图。
限度:按外标法以头孢他啶峰面积计算,含头孢他啶聚合物的量不得过0.3%。
吡啶
照高效液相色谱法(通则0512)测定。
pH7.0磷酸盐缓冲液:称取无水磷酸氢二钠5.68g、磷酸二氢钾3.63g,加水溶解并稀释至1000mL。
供试品溶液:取本品约0.66g,精密称定,置100mL量瓶中,加pH7.0磷酸盐缓冲液溶解并稀释至刻度(于15℃以下贮存,1小时内进样完毕),摇匀。
对照品溶液:取吡啶约1g,精密称定,置100mL量瓶中,用水稀释至刻度,摇匀,精密量取10mL,置100mL量瓶中,用水稀释至刻度,摇匀,于15℃以下贮存。临用前精密量取2mL,置200mL量瓶中,用pH7.0磷酸盐缓冲液稀释至刻度,摇匀。
色谱条件:用十八烷基硅烷键合硅胶为填充剂,以乙腈-0.25mol/L磷酸二氢铵溶液(取磷酸二氢铵57.515g,加水溶解并稀释至2000mL-水(300:100:600),用氨溶液调节pH值至7.0为流动相,流速为每分钟1.0mL,检测波长为254nm,进样体积20µL。
系统适用性要求:理论板数按吡啶峰计算不低于3000,取对照品溶液注入液相色谱仪,计算数次进样结果,其相对标准偏差不得过3.0%。
测定法:精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。
限度:按外标法以峰面积计算出供试品中吡啶的含量,不得过0.12%。
干燥失重
取本品,在60℃减压干燥至恒重(通则0831),减失重量应为13.0%~15.0%。
炽灼残渣
取本品1.0g,依法检查(通则0841),遗留残渣不得过0.2%。
重金属
取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
可见异物
取本品5份,每份各3.0g,加1%碳酸钠溶液(经0.45μm滤膜滤过)溶解,依法检查(通则0904),应符合规定。
不溶性微粒
取本品,加1%碳酸钠溶液(经0.45µm滤膜滤过)溶解制成每1mL中含30mg的溶液,依法检查(通则0903),每1g样品中含10µm及10µm以上的微粒不得过6000个,含25µm及25µm以上的微粒不得过600个。(供无菌分装用)
细菌内毒素
取本品,依法检查(通则1143),每1mg头孢他啶(按C22H22N6O7S2)中含内毒素的量应小于0.10EU(先加1%无内毒素的碳酸钠溶液将供试品溶解并稀释制成每1mL中含80mg的溶液,再用内毒素检查用水稀释至所需浓度)。(供注射用)
无菌
取本品,用适量1%无菌碳酸钠溶液溶解并稀释后,经薄膜过滤法处理,依法检查(通则1101),应符合规定。(供无菌分装用)
含量测定
照高效液相色谱法(通则0512)测定。
供试品溶液
取本品适量(约相当于头孢他啶,按C22H22N6O7S2计0.25g),精密称定,置250mL量瓶中,加水使头孢他啶溶解并稀释至刻度,摇匀,精密量取15mL,置100mL量瓶中,用水稀释至刻度,摇匀。
对照品溶液
取头孢他啶对照品,精密称定,加水使头孢他啶溶解并定量稀释制成每1mL中约含头孢他啶(按C22H22N6O7S2计)0.15mg的溶液。
色谱条件
用十八烷基硅烷键合硅胶为填充剂,以乙腈pH7.0磷酸盐缓冲液(称取无水磷酸氢二钠42.59g、磷酸二氢钾27.22g,加水溶解并稀释至1000mL)-水(40:200:1760)为流动相,流速为每分钟1.5mL,检测波长为254nm,进样体积20µL。
系统适用性要求
对照品溶液色谱图中,头孢他啶峰与相邻杂质峰之间的分离度应符合要求。
测定法
精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算供试品中C22H22N6O7S2的含量。
类别
β-内酰胺类抗生素,头抱菌素类。
贮藏
密封,在凉暗处保存。
制剂
注射用头孢他啶。
药品简介
作用机制
头孢他啶的抗菌作用机制为影响细菌细胞壁的合成。与其他头孢菌素类药相似,该品能抑制转肽酶在细胞壁合成的最后一步交叉连接中的转肽作用,使交叉连接不能形成,从而影响细胞壁合成,导致细菌溶菌死亡。
药理作用
对革兰阴性杆菌产生的广谱β-内酰胺酶高度稳定,对革兰阴性杆菌抗菌作用强,明显超过第一代和第二代头孢菌素,但对革兰阳性球菌抗菌作用不如第一代和部分第二代头孢菌素。头孢他啶为目前临床应用的活性较高的头孢菌素类药。其对铜绿假单胞菌的体外作用稍弱于某些氟喹喏酮类药物,但远较哌拉西林、阿帕西林、阿洛西林、羧苄西林等为强,亦优于庆大霉霉素和阿米卡星,与妥布霉素相仿或略优。头孢他啶对铜绿假单胞菌等假单胞菌属、大肠杆菌、克雷白菌属、吲哚阳性及阴性变形杆菌、普鲁威登菌、沙门菌属、沙雷菌属和志贺菌属等以及小肠结肠炎耶尔森菌等革兰阴性杆菌具高度抗菌活性;部分枸橼酸菌属、流感杆菌、卡他莫拉菌和萘瑟菌属、葡萄球菌和链球菌属也对头孢他啶敏感。但耐甲氧西西林葡萄球菌、肠球菌属和单核细胞增多性李斯特菌、大多数脆弱拟杆菌和艰难梭菌对头孢他啶耐药。
药代动力学
1、头孢他啶口服不吸收,静脉或肌内注射该品后迅速广泛分布于体内组织及体液中,可分布到内脏组织、皮肤和肌肉、骨、关节、痰液、腹水、胸水、羊水、脐带血、胆汁、子宫附 件、心肌中;易透过胎盘屏障进入胎盘,亦能分布至房水、乳汁。该品难以通过正常的血脑屏障,当脑膜受损或发炎时,可透过受损脑膜进入脑脊液中。
2、该品在体内几乎不发生代谢生物转换,主要以呈高度活性的原形药物随尿液排泄。给药24小时内近80~90%的剂量随尿液排泄,另有少于1%的剂量可通过胆汁排泄。故尿液中浓度很高,肠道浓度极微。正常人反复给药未见蓄积作用,但肾功能不全者、新生儿、早产儿药物排泄时间延长,药物可在体内蓄积。
3、该品的血药浓度与剂量有关,血清蛋白结合率为10%~17%。肌内注射、静脉注射、静脉滴注的血浆半衰期均为2小时。肾功能不全或新生儿血浆半衰期较健康成人延长2~2.5倍。
4、健康成人肌内注射该品0.5或1g后,1~1.2小时血药浓度达血药峰浓度,分别为22.6mg/L和38.3mg/L。静脉注射和静脉滴注该品1.0g后的血药峰浓度分别为120.5mg/L和105.7mg/L。
适应症
头孢他啶临床上用于敏感菌所致的下列感染:
1、呼吸道感染,如肺炎、支气管炎、肺脓肿、肺囊性纤维病变、感染性支气管扩张等。该品也可用于治疗囊肿纤维化病人合并假单孢菌属肺感染。
2、泌尿、生殖系统感染,如急性或慢性肾盂肾炎、尿道炎、子宫附件炎、盆腔炎等。
3、腹内感染,如胆囊炎、胆管炎、腹膜炎等。
4、皮肤及皮肤软组织感染,如蜂窝组织炎、严重烧伤或创伤感染。
5、严重耳鼻喉感染,如中耳炎、恶性外耳炎、鼻窦炎等。
6、骨、关节感染,如骨炎、骨髓炎、脓毒性关节炎等。
7、其它严重感染,如败血症、脑膜炎等。
8、手术前预防感染。
注意事项
1、交叉过敏
患者对一种头孢菌素或头霉素(cephamycin)过敏者对其它头孢菌素或头霉素也可能过敏。对青霉素类、青霉素衍生物或青霉胺过敏者也可能对头孢菌素或头霉素过敏。
2、禁忌症
(1)对该品或其它头孢菌素类药物过敏的患者禁用。
(2)有黄疸的新生儿或有黄疸严重倾向的新生儿禁用。
3、慎用
(1)对青霉素类抗生素药过敏的患者慎用。
(2)孕妇、早产儿、新生儿的用药安全性尚未确定,故孕妇、哺乳期妇女应慎用。
(3)严重肝功能衰竭伴肾功能不全者慎用。
(4)高度过敏性体质、高龄体弱患者慎用。
4、对诊断的影响
(1)使用该品时,应用碱性酒石酸铜试液进行尿糖试验可呈假阳性。
(2)直接抗人球蛋白试验(Combs试验)约5%患者可呈阳性反应。
(3)少数患者用药后偶有丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、乳酸脱氢酶和碱性磷酸酯酶值升高,尿素氮、肌酸、肌酐升高;中性粒细胞减少,嗜酸细胞增多等。
5、长期用药时应常规监测肝、肾功能和血象。
6、有肝、肾功能损害和(或)胆道阻塞患者使用该品时应进行血药浓度监测。
不良反应
该品的不良反应轻而少见(发生率约2.5%),并且该品不影响凝血酶原合成,亦无其它凝血机制障碍发生。
1、过敏反应以皮疹、荨麻疹、红斑、药热、支气管痉挛和血清病等过敏反应多见,少见过敏性休克症状。
2、消化道反应少数病人有恶心、呕吐、食欲下降、腹痛、腹泻、胀气、味觉障碍等胃肠道症状,偶见伪膜性肠炎。
3、血液学改变少数患者用药后可出现中性粒细胞减少、嗜酸粒细胞增多。
4、肝毒性少数患者用药后可出现一过性肝酶升高。
5、肾毒性少数患者用药后偶可出现尿素氮、肌酸、肌酐升高。
6、中枢神经反应用药后偶见头痛、眩晕、感觉异常等中枢神经反应的症状;少见癫痫发作。
7、二重感染少数病人长期应用该品可导致耐药菌的大量繁殖,引起菌群失调,发生二重感染。偶见念球菌病(包括鹅口疮、阴道炎等)。
8、少数病人长期应用该品可能引起维生素K、维生素B缺乏。
9、应用该品期间饮酒或接受含酒精药物者可出现双硫仑样(disulfirm)反应(病人面部潮红、头痛、眩晕、腹痛、胃痛、恶心、呕吐、气促、心率加快、血压降低、嗜睡、幻觉等)。
10、肌内注射时,注射部位可能引起硬结、疼痛;静脉给药时,如剂量过大或速度过快可产生血管灼热感、血管疼痛,严重者可致血栓性静脉炎。
用药过量
1、用药过量的症状:注射处疼痛、发炎和静脉炎;眩晕、头痛;有肾功能障碍患者引起癫痫发作等。
2、药物过量时的处理:立即停药,保护患者的气道通畅;注意监护和维护患者的生命体征、血气、电解质等;对严重过量患者可应用血液透析和腹膜透析清除部份药物。
用法用量
成人肌内注射
1、轻至中度感染:每次剂量0.5~1g,每12小时1次。溶于0.5~1%利多卡因溶剂2~4mL中作深部肌内注射。
2、重度感染并伴有免疫功能缺陷者(包括中性粒细胞减少者):每次剂量可酌情递增至2g,每8~12小时1次。
3、单纯性尿路感染:每12小时0.25~0.5g。
4、复杂性尿路感染:每8~12小时500mg。
5、骨、关节感染:每12小时2g。
6、单纯性肺炎和皮肤软组织感染:每8小时0.5~1g。
静脉给药
1、轻至中度感染:每次0.5~1g,每12小时1次。
2、重度感染并伴有免疫功能缺陷者(包括中性粒细胞减少者):每次剂量可酌情递增至2g,每8-12小时1次。
3、单纯性尿路感染:每12小时0.25~0.5g。
4、复杂性尿路感染:每8~12小时500mg。
5、骨、关节感染:每12小时2g。
6、单纯性肺炎和皮肤软组织感染:每8小时0.5~1g。
7、前列腺手术前预防用药:在麻醉诱导期给予1g,并在移走导管时给予第二次剂量。
8、囊肿纤维化病人:囊肿纤维化病人合并假单孢菌属肺感染但其肾功能正常时,应给予大剂量的头孢他啶。每日按100-150mg/kg,分成3次给药。
老年人剂量
治疗65岁以上老年感染时的给药量可减少至正常量的2/3~1/2,每日剂量不超过3g。
透析时剂量
正在进行血液透析的患者,建议用1g的负荷量,每次血液透析后再加用1g。对在进行腹膜透析的患者可用1g的负荷量,接着每12小时给0.5g。
儿童静脉给药
1、新生儿(出生体重大于2kg):日龄不超过7日者,每8小时30mg/kg,超过7日者,每8小时50mg/kg。
2、儿童:每日剂量50-150mg/kg;分3次用药,每日极量为6g
药物相互作用
1、该品与下列药物有配伍禁忌:硫酸阿米卡星、庆大霉素、卡那霉素、妥布霉素、新霉素、盐酸金霉素、盐酸四环素、盐酸土霉素、粘菌素甲磺酸钠、硫酸多粘菌素B、葡萄糖酸红霉素、乳糖酸红霉素、林可霉素、磺胺异恶唑、氨茶碱、可溶性巴比妥类、氯化钙、葡庚糖酸钙、盐酸苯海拉明和其它抗组胺药、去甲肾上腺素、间羟胺、哌甲酯、琥珀胆碱等。偶亦可能与下列药物发生配伍禁忌:青霉素、甲氧西林、琥珀酸氢化可的松、苯妥英钠、丙氯拉嗪、维生素B族和维生素C、水解蛋白。
2、在碳酸氢钠溶液中的稳定性较在其他溶液中为差。
3、该品不可与氨基糖苷类抗生素在同一容器中给药。与万古霉素混合可发生沉淀。
4、该品与氨基糖苷类抗生素或速尿等强利尿剂合用时需严密观察肾功能情况,以避免肾损害的发生。
安全信息
安全术语
S26;:In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.
眼睛接触后,立即用大量水冲洗并征求医生意见。
S36:Wear suitable protective clothing.
穿戴适当的防护服。
风险术语
R20/21/22:Harmful by inhalation, in contact with skin and if swallowed.
吸入、与皮肤接触和吞食是有害的。
杂质、分离纯化业务介绍
桐晖药业公司成立20多年,提供原料/参比制剂的同时,拥有一个高水平的合成定制和分离纯化团队、提供高难度定制合成和分离纯化服务,建立了完善的杂质分离技术平台,可以快速的帮您得到所需的杂质纯品,特别擅长高难度的微量杂质标样制备,比如(万分之一等极低含量,溶解度差,稳定性差,分离度差,保留弱,发酵类药物杂质),可以提供合理的监测和控制方法,分离和纯化其过程中产生的微量未知杂质。帮您轻松解决杂质研究的难题。严格把控质量关,配套资质齐全,所有杂质均可提供COA。现除自有高端定制品牌TOREF外,也代理了包括中检所、BP、USP、EP、TLC 、LGC、TRC等品牌的销售,品类齐全,价格有竞争力。
专业分离纯化制备服务(高难度项目解决方案):
1、含量低
2、分离度差
3、稳定性差
4、溶解性差
5、保留弱
6、无紫外吸收
我们的优势:
1、专业团队,完善的平台,分离纯化技术成熟,经验丰富
2、药物研发和注册过程中所需的相关杂质的定制合成
3、药物研究多成分粗品,提供分离纯化和结构解析
4、擅长分离低含量,分离度差,无紫外吸收的成分
5、多种分离技术组合,周期短,成功率高,价格优
6、毫克级,克级,公斤级纯化、技术转让
7、提供完整的资料COA等相关检测数据满足申报要求
8、快速高效交付,品质高,售后服务质量好
成功案例对卡磺钠注射液多个杂质分离纯化,确定结构,帮助客户解决生产难题
桐晖药业,基于核磁、色谱及其联用技术,在分离纯化、结构确证细分领域潜心钻研十余载,现为您提供技术专属性强、纯度高、重现性好、结构确证无误的专业解决方案,助力药品研发。
关键字: 头孢他啶杂质14;头孢他啶杂质14杂质;头孢他啶杂质14对照品;头孢他啶杂质14杂质制备;头孢他啶杂质14分离纯化;
广州市桐晖药业有限公司成立于1999年,国家GSP认证,主要经营中西药制剂及化学原料、医药化工原料和医药中间体等产品。桐晖拥有雄厚的经济实力,是一家集市场营销、学术推广、进出口、新产品研发、合作生产为一体的现代企业。
桐晖药业是行业中的进口药专家,积极快速引进国外战略性新产品,尤其是国内紧缺或空白的新产品,已与全球各大药企建立深入的合作关系,致力于将国际上最新、最好的产品引入中国市场,打造中国医药行业排头兵。
桐晖药业是世界新产品进出口的专业平台,在国际医药界享有很高的名望和美誉。它拥有一支专业的营销部、市场部和进口注册团队,具有专业的产品打造力,高度准确的终端占有力,打造同类产品中的优秀品