对结构独特、活性显著的复杂天然产物进行生物合成研究需要从基因、途径及酶催化反应的角度理解自然界生物-化学合成、调控及拮抗的过程,属于典型的有机化学-微生物学-生物化学-天然产物药学的交叉学科,对于天然产物药物研究中重点关注新结构的发现、创造和复杂化合物的高效制备均具有重要的推动作用。
自1974年萘啶霉素(Naphthyridinomycin,NDM)首次分离,四氢异喹啉生物碱类(Tetrahydroisoquinline, THIQ)天然产物已有四十余年的研究历史。该家族化合物共包括60多种分子,大多具有显著的抗菌及抗肿瘤活性。代表性化合物除NDM外还包括假单胞菌产生的番红菌素(Safracin)、链霉菌产生的番红霉素A(Saframycin A, SFM-A)及加勒比海鞘分离到的Ecteinascidin 743(ET-743)。特别是ET-743作为例海洋天然产物来源的抗肿瘤新药于2007年在欧洲获批,随后于2015年获得美国FDA批准上市。该家族化合物在有机合成和药物化学领域一直备受青睐,其生物合成途径和涉及的详细酶学机制也引起化学家和生物学家的广泛关注。
中国科学院上海有机化学研究所生命有机化学国家重点实验室的唐功利研究团队多年来一直致力于该家族化合物的生物合成与合成生物学研究。最近该团队成功解密SFM-A生物合成过程最后的修饰步骤,该过程涉及两个关键蛋白SfmE和SfmCy2,它们分别参与SFM-A生物合成中后期独特的前药激活(Prodrug-activation)及胞外脱氨(Extracellular deamination)修饰过程。
2008年,唐功利与刘文课题组合作首先克隆了SFM-A的生物合成基因簇,初步提出其生物合成途径。在随后的研究中课题组成员唐满成博士发现并证实了蛋白SfmD以过氧化氢为氧化剂催化3-甲基酪氨酸芳香环发生羟基化。而日本的Hideaki Oikawa课题组通过体外生化实验重构SFM-A的THIQ核心骨架结构,并发现SfmC催化两次连续的Pictet-Spengler反应形成分子骨架,该过程中长链脂肪酸起到了非常关键的导向作用。在最新的研究中,通过前期工作的积累以及对SFM-A基因簇的进一步分析,唐功利研究团队提出以下假设:SfmC在细胞体内催化生成SFM-A的分子骨架化合物,然而其携带的脂肪酸长链保护细胞内的DNA不受到伤害;随后跨膜蛋白SfmE将中间产物中的长链保护基解离,同时小分子被泵出胞外,实现前药激活并裸露一个氨基,随后分泌型氧化酶SfmCy2催化一步脱氨反应,将该氨基消除并形成最终产物SFM-A(化合物1)。
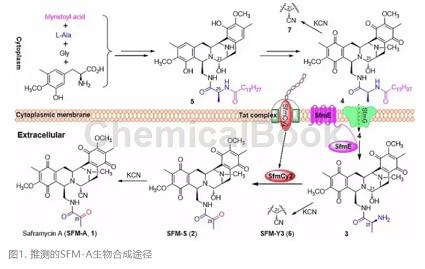
图1. 推测的SFM-A生物合成途径
基于以上假设,该团队设计了相关实验,将SfmCy2在S. lividans 1326中异源表达,结果显示SfmCy2能分泌到胞外;随后他们对胞外分泌蛋白富集后进行端基测序,测序结果表明SfmCy2与生物信息学分析的结论一致:胞外分泌蛋白缺失N-端信号肽序列,属于双精氨酸转运(Twin-arginine translocation, Tat)蛋白同源的分泌蛋白,在胞外行使催化功能。同时,他们在氰化钾处理后SfmE的缺失突变体发酵液中检测到氰基化的长链脂肪酰中间体(图1,化合物7),随后的全细胞转化和膜蛋白组分生化实验进一步表明蛋白SfmE解离了中间体的长链脂肪酸,生成化合物3,发生前药激活。他们同样通过SfmCy2的体内敲除及体外酶催化实验,进一步证明其胞外脱氨修饰的酶学功能,并发现最终生成的羰基官能团中氧来源于H2O。
该工作揭示了SFM-A生物合成中的前药活化机制及独特的胞外脱氨修饰机制,不仅补充了SFM-A生源合成路径的最后一环,也是整个THIQ家族生物合成研究中的重要一步,为进一步在分子水平上调控THIQ家族化合物的组合生物合成及合成生物学研究奠定了理论基础。
这一成果近期发表在Angewandte Chemie International Edition 上,宋立强博士、研究生章盈盈和蒲津越博士为并列作者。
