1343-98-2
中文名称
硅酸
英文名称
SILICIC ACID
CAS
1343-98-2
EINECS 编号
215-683-2
分子式
H2O3Si
MDL 编号
MFCD00054122
分子量
78.1
MOL 文件
1343-98-2.mol
更新日期
2026/02/10 08:41:28
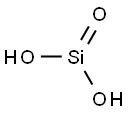 1343-98-2 结构式
1343-98-2 结构式
基本信息
中文别名
硅酸含水二氧化硅
矽酸
英文别名
HYDRATED SILICAPRECIPITATED SILICA
SILICA
SILICA ACID
SILICIC ACID
cubosic
g952
h-ilerit
hydrosilisicacid
k320ds
k60(silicate)
mikronisil
neoxylet
polyorthosilicicacid
polysilicicacid
precipitated
silicicacid(polyortho)
siliconhydroxide
siltontf06
sipernat17
所属类别
无机化工:硅化物及硅酸盐物理化学性质
外观性状玻璃状无色透明的无定形颗粒。相对密度2.1~2.3。溶于氢氟酸和苛性钾(钠)。不溶于水和醇。
密度0.230 g/cm3
储存条件Store at room temperature, keep dry and cool
形态powder
颜色白色
气味 (Odor)Odorless
水溶解性易溶于水。
Merck13,8564
Dielectric constant2.0(Ambient)
介电常数2.0(Ambient)
稳定性稳定的。
化妆品成分功效ANTICAKING
VISCOSITY CONTROLLING
OPACIFYING
ABRASIVE
BULKING
ABSORBENT
VISCOSITY CONTROLLING
OPACIFYING
ABRASIVE
BULKING
ABSORBENT
InChIInChI=1S/H2O3Si/c1-4(2)3/h1-2H
InChIKeyIJKVHSBPTUYDLN-UHFFFAOYSA-N
SMILES[Si](O)(O)=O
EPA化学物质信息Silicic acid (1343-98-2)
常见问题列表
二元弱酸
硅酸是一种几乎不溶于水的二元弱酸,K1约为10-9,K2约为10-12。硅酸不能用二氧化硅和水直接反应制得,而是由硅酸盐与酸作用来制取。制得的硅酸,由于溶液的浓度不同,或者形成白色溶胶,或者成为凝胶状沉淀析出。硅酸也可缩合,形成多酸,可以所含水分的多少来加以区别。和各种硅酸盐相应的硅酸有正 (原) 硅酸H4SiO4(SiO2+2H2O),偏硅酸 H2SiO3(SiO2+H2O),三硅酸 H4Si3O8(3SiO2+2H2O)等。组成的通式为xSiO2·yH2O,式中x,y都是正整数。x>1的硅酸叫多硅酸。目前已确定的有正硅酸、偏硅酸、二硅酸H6Si2O7和三硅酸等。因为偏硅酸式子最简单,在反应中,一般把硅酸写成H2SiO3。如果把硅酸凝胶中所含的水经过干燥而脱去,则变为白色透明多孔性的固体物质,称为硅胶。它有很大的吸附能力,能吸收多种气体和蒸汽。因此,常用来作吸附剂、干燥剂和某些催化剂的载体。以上信息由Chemicalbook的andy编辑整理。
理化性质
硅酸原称偏硅酸,化学式H2SiO3,式量78.10。白色无定形粉末,不溶于水。是一种二元弱酸,电离平衡常数K1=2×1010(室温)。天然硅酸以盐形式大量存在。不溶于盐酸、硫酸,溶于氢氟酸和氢氧化钾、氢氧化钠的碱溶液,生成硅酸钾K2SiO3或硅酸钠Na2SiO3和水。熔点为150℃(分解)。加热到150℃以上时分解为二氧化硅和水,二氧化硅是硅酸酐。
单分子硅酸可溶于水,为二元弱酸,在溶液中逐渐缩合形成不溶的多酸,得到一种胶体溶液,称“硅酸溶胶”,后者加电解质,或在适当浓度的硅酸盐溶液中加酸,则得硅酸凝胶,脱水后得多孔性固体,称“硅胶”。可用做气体和蒸气的吸收剂、催化剂或做其它催化剂的载体。由于二氧化硅不跟水化合,所以硅酸主要通过硅酸盐溶液跟强酸反应制得。
二氧化硅水合物
硅酸亦称“水合二氧化硅”,化学结构通式为xSiO2·yH2O。无定形二氧化硅的水合物。目前被确认的硅酸有正硅酸H4SiO4(x=1、y=2),偏硅酸H2SiO3(x=1、y=1),二硅酸H2Si2O5(x=2、y=1),焦硅酸H6Si2O7(x=2、y=3)。硅酸组成复杂,往往随生成条件而异。它们在水中的溶解度较小。可溶性硅酸盐稀溶液与酸作用制得正硅酸的不稳定水溶液:Na4SiO4+4HCl=H4SiO4+4NaCl,生成的单分子酸放置一段时间后逐渐缩合成多分子聚合物,称为硅酸溶胶(mSiO2·nH2O),简称硅溶胶。工业上通常用离子交换法使水玻璃脱钠制取。它是半透明乳白色液体,市售商品中二氧化硅含量一般为20~30%,高的可达50%,胶粒直径为(1~2)×10-8米(有些粗到1. 3×10-7米)。高浓度硅溶胶通常需借助微量氧化钠保持其稳定性。硅溶胶是重要的催化剂载体材料。制作催化剂时,将活性组分的溶液与硅溶胶混合,经喷雾干燥制成微球状催化剂。硅溶胶还用作羊毛纺制过程中上浆的胶剂,以减少羊毛纤维的断头率。游离态硅酸
游离态的硅酸包括偏硅酸H2SiO3和二硅酸H2Si2O5,酸性很弱。偏硅酸的电离平衡常数K=2×10-10(室温),其分子式实际应写成SiO2· nH2O,其中水分子数目视制备条件而定。仅能在0℃左右存在,受热或干燥时逐渐减少水分,在150℃时成为二氧化硅。将酸加入可溶性的硅酸盐溶液都可以得到硅酸。游离出来的单分子硅酸可溶于水,但在溶液中逐渐聚合成二分子、三分子,最后形成不溶解的多分子聚合物,得到一种胶体溶液,称作硅酸溶胶。如果硅酸盐浓度较大,则加酸后直接形成硅酸胶冻,脱水后得到硅酸凝胶。硅酸凝胶有较强的吸附性,广泛用于吸收各种蒸汽或气体及精炼石油等方面,并可用作催化剂的载体。它的另一种类型是正硅酸Si(OH)4或写作H4SiO4,电离平衡常数K=2.2×10-10(30℃),也是一个弱酸,它的盐在水溶液中有水解作用。当pH在2—3的范围内是稳定的,但过饱和的H4SiO4长期放置会有无定形的SiO2沉淀,并以胶态粒子、沉淀物或凝胶出现,脱水后亦可得到硅酸凝胶。硅酸盐
硅酸盐是指硅酸的盐类,实际是硅、氧及金属结合而成的化合物的总称。在地壳中分布极广,是构成多数岩石(如花岗岩)和土壤的主要成分。大都是晶体,可分为可溶于水和不溶于水的两大类。可溶于水的硅酸盐具有一般的组成,aM2O·bSiO2·xH2O (M为碱金属元素)。在可溶性硅酸盐中,最常见的是硅酸钠Na2SiO3,其水溶液叫水玻璃。它是弱酸强碱盐,水溶液显强碱性,化工生产中有时可代替烧碱使用,因而也称作泡化碱。水玻璃可用作粘合剂,防火涂料和蛋类防腐剂。除碱金属硅酸盐是可溶盐外,其他许多硅酸盐都是难溶的,而且结构也十分复杂。在自然界中分布很广,种类也繁多。长石、云母、石棉、滑石等都是最常见的天然硅酸盐。它们的化学式很复杂,一般认为,它们是酸性氧化物和碱性氧化物相结合的化合物。常用氧化物的式子来表示所组成的硅酸盐的化学式,如:长 石 K2O·Al2O3·6SiO2或K2Al2Si6O16
白云母 K2O·3Al2O3·6SiO2·2H2O或K2H4Al6(SiO4)6
高岭土 Al2O3·2SiO2·2H2O或Al2H4Si2O9
石 棉 CaO·2MgO·4SiO2或Mg2Ca(SiO3)4
滑 石 3MgO·4SiO2·H2O或Mg3H4(SiO3)4
泡沸石 Na2O·Al2O3·2SiO2·nH2O或Na2Al2(SiO4)2·nH2O
难溶硅酸盐中,也有一些是人工合成的,如硅铝吸附剂。由于硅氧原子间有牢固的化学键,硅酸盐具有良好的化学稳定性、机械强度、耐火度及较高的熔点。它们不仅是硅酸盐工业的主要原料,也是建筑工业的重要材料。
参考资料:林崇德,姜璐,王德胜 主编;王德胜 分卷主编.中国成人教育百科全书·化学·化工。
