2296729-00-3
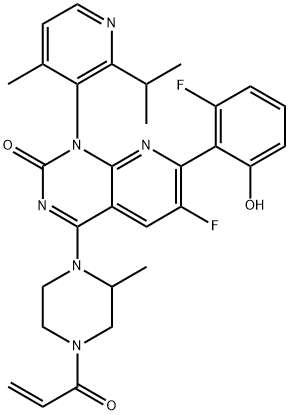 2296729-00-3 结构式
2296729-00-3 结构式
基本信息
索托拉西
AMG510单一构型
(1R)-6-氟-7-(2-氟-6-羟基苯基)-1-[4-甲基-2-(1-甲基乙基)-3-吡啶基]-4-[(2S)-2-甲基-4-(1-氧代-2-丙烯-1-基)-1-哌嗪基]-吡啶并[2,3-D]嘧啶-2(1H)-酮
CID 137278711
AMG-510(Sotorasib)
PYRIDO[2,3-D]PYRIMIDIN-2(1H)-ONE, 6-FLUORO-7-(2-FLUORO-6-HYDROXYPHENYL)-1-[4-METHYL-2-(1-METHYLETHYL
6-fluoro-7-(2-fluoro-6-hydroxyphenyl)-1-(4-methyl-2-propan-2-ylpyridin-3-yl)-4-[(2S)-2-methyl-4-prop-2-enoylpiperazin-1-yl]pyrido[2,3-d]pyrimidin-2-one
Pyrido[2,3-d]pyrimidin-2(1H)-one, 6-fluoro-7-(2-fluoro-6-hydroxyphenyl)-1-[4-methyl-2-(1-methylethyl)-3-pyridinyl]-4-[(2S)-2-methyl-4-(1-oxo-2-propen-1-yl)-1-piperazinyl]-, (1R)-
物理化学性质
常见问题列表
索托拉西布的合成包含9个步骤。合成路线始于烟酸衍生物28.1的酰胺化,形成烟酰胺28.2。随后用草酰氯处理,加入氨基吡啶28.3,通过异氰酸酯中间体生成脲28.4。脲28.4没有被分离出来,而是直接进行了碱介导的环化反应,生成嘧啶二酮28.5。此时,使用(+)-2,3-二苯甲酰-D-酒石酸((+)-DBTA)在2-甲基四氢呋喃(2-MeTHF)和庚烷中处理进行经典拆分,可以分离出所需的异构体共晶体28.6(2-MeTHF溶剂),其比例大于 2000:1,通过使用单磷酸二钠调节pH值并从MTBE和庚烷中分离,可以分离出游离碱。为了提高合成产率,可以从28.6过滤后的母液中回收不需要的异构体,首先进行盐的分解以去除过量的(+)-DBTA,然后将游离碱在300°C高温下的茴香醚中处理,得到外消旋的28.5。
用POCl3处理二酮28.6得到氯化物28.7,为随后与哌嗪衍生物28.8的SNAr反应生成哌唑啉28.9创造条件。与硼氧嗪28.10的铃木偶联生成了中间体28.11。接着,溶解28.11并用SiThiol
scavaenger处理,除去残留的Pd,再加入反式脂肪酸裂解Boc保护基,得到胺28.12,然后用丙烯酰氯进行酰胺化反应,形成28中的丙烯酰胺。用乙醇和水进行重结晶,得到最终产品Sotorasib(28),中间体28.6的总收率为65%。
| Target | Value |
|
K-Ras(G12C)
() |
AMG 510抑制SOS1催化的重组突变体KRAS (G12C/C118A)的核苷酸交换,但对单突变KRAS (C118A)影响甚微。AMG 510选择性地降低含KRAS p.G12C突变的细胞系生存活力,而对含其它KRAS突变的细胞系无影响。
在临床前肿瘤模型中,AMG 510可快速地以不可逆方式结合KRAS (G12C),持久地抑制MAPK信号通路。对含KRAS(G12C)突变的小鼠肿瘤模型通过口服途径单次给药,AMG 510能够诱导肿瘤消退。
