背景及概述[1]
特立帕肽是一种合成的34肽,为人甲状旁腺素PTH的1-34氨基酸片段,氨基酸顺序 如下:H-Ser1-Val2-Ser3-Glu4-Ile5-Gln6-Leu7-Met8-His9- Asn10-Leu11-Gly12-Lys13-His14-Leu15-Asn16-Ser17-Met18-Glu19-Arg20-Val21-Glu22-Trp23-Leu24-Arg25-Lys26-Lys27-Leu28-Gln29-Asp30-Val31-His32-Asn33-Phe34-OH。该片段是含有84个氨基酸的内源性甲状旁腺素PTH具有生物活性的N-末端区域。 本品的免疫学和生物学特性与内源性甲状旁腺素PTH以及牛甲状旁腺素PTH(bPTH)完全相同。特立帕肽是种获得美国食品及药物管理局FDA批准的骨形成剂类新药,这种甲状旁腺激素的衍生物可以通过增加成骨细胞的活性及数量而促进骨生长,而目前的常规骨质疏松药物一般只是作用于破骨细胞而减缓或阻断骨质流失,醋酸特立帕肽是由礼来药厂生产的,涉及到1637例绝经后骨质疏松症患者的临床研究结果显示,与那些只服用了钙和维 生素D补加剂的患者相比,96%的患者在接受该药治疗后,其脊柱和臀部的骨(矿物质)密度 BMD均表现出显著增加,此外还发现,该药能够分别减少发生脊柱骨折和其他类型骨折危险 的65%和53%。

适应证[2]
美国FDA批准用于绝经后女性骨质疏松症以及高度骨折风险的男性骨质疏松症(包括性腺功能减退引起的继发性骨质疏松症)的治疗。对22例绝经后骨质疏松症妇女分别应用特立帕肽20 μg· d-1与每周利塞膦酸钠35 mg,在开始治疗前、治疗后第3个月、第6个月观察骨转换指标改变,1年后停用药物。研究发现,反映骨形成相关指标如血清碱性磷酸酶(ALP)、Ⅰ型原胶原N端前肽(PINP)在特立帕肽组明显增加(P<0.001),而在利塞膦酸钠组明显下降(P<0.001);反映骨吸收指标血清Ⅰ 型胶原C端肽(CTX)在特立帕肽组也增加,而在利塞膦酸钠组下降,提示特立帕肽独特促进骨形成与骨吸收的双重作用。本品是目前已上市药物中惟一促进骨形成的药物,我国正在进行该药的Ⅳ期临床试验。
临床应用[2]
1.治疗原发性骨质疏松症
目前原发性骨质疏松症常规治疗药物如双膦酸盐、降钙素、雌激素类,作用机制均是通过抑制破骨细胞活性达到治疗骨质疏松症效果,而特立帕肽是目前惟一认为具有促进骨合成代谢的药物。单独或联合应用特立帕肽,可以增加骨密度、改善骨微结构、降低骨折风险。多数临床研究均证明,特立帕肽增加骨密度作用呈剂量依赖性增加,虽然40 μg·d-1组增加骨密度效果优于20 μg·d-1组,但是并没有进一步降低骨折风险,且不良反应风险可能更大。
1)特立帕肽与双膦酸盐
多项临床试验证明特立帕肽增加骨密度、减少骨折风险作用强于阿仑膦酸钠。目前临床不推荐本品与双膦酸盐联用。在83 例腰椎骨密度降低男性患者中发现单独应用特立帕肽治疗后,其骨密度增加效果不但优于单用阿仑膦酸钠治疗,也优于两者联合治疗。研究中同时发现使用阿仑膦酸钠后骨形成标志物骨钙素(BGP),PINP和骨吸收标志物CTX均有所下降,随着特立帕肽的加入这些标志物浓度才有所上升,推测特立帕肽促进骨形成的作用会受到阿仑膦酸钠的不利影响。但目前大多数研究支持双膦酸盐类作为特立帕肽结束治疗后下一步治疗的选择药物。
2)特立帕肽与选择性雌激素受体调节剂
将137 例绝经后骨质疏松症妇女分为2组,一组接受特立帕肽20 μg· d-1及雷洛昔芬60mg· d-1联合治疗,另一组单独应用特立帕肽20 μg·d-1,观察6个月后发现两组PINP水平均明显升高,两组相比无统计学差异;而CTX的浓度在联合治疗组低于单用特立帕肽组(P=0.015),提示本品联合应用雷洛昔芬可以在促进骨形成的同时抑制骨吸收;两组骨密度较治疗前基线水平均明显上升,但联合治疗组髋部骨密度增加较单用特立帕肽组更明显(P=0.04);联合治疗组不良反应发生率与单用特立帕肽组相似,推测联合应用雷洛昔芬可以加强特立帕肽促成骨的作用。因此单用雌激素受体调节剂治疗效果不佳的患者可以考虑联合本品治疗。
3)特立帕肽与降钙素
对亚洲地区63例绝经后骨质疏松的妇女随机分成2组,分别接受特立帕肽20 μg· d-1及降钙素100 IU· d-1治疗,6个月后发现特立帕肽治疗组脊柱骨密度较降钙素组明显增加,且骨转换指标改变更加明显(骨特异性ALP142% vs37%;骨钙素154% vs23%,P<0.001),显示特立帕肽组促进骨形成作用要优于降钙素。目前还没有本品与降钙素联用的相关文献报道。且无研究支持降钙素作为特立帕肽治疗结束后的后续治疗药物。
4)与维生素D和钙剂联用
对绝经后骨质疏松症妇女研究发现,在钙剂和维生素D使用基础上,同时接受特立帕肽20 μg· d-1,统计结果显示钙剂与维生素D联用特立帕肽可以增加腰椎骨密度并降低非椎体骨折风险,因此考虑本品与上述两种药物联用具有协同作用。
2.治疗继发性骨质疏松症
通过骨密度检查筛选出437例男性原发性骨质疏松症或性腺功能减退引起的继发性骨质疏松症患者,随机分为3组(安慰剂组、特立帕肽20和40 μg· d-1组)。所有患者均接受钙剂与维生素D的基础治疗。11个月观察期结束后,特立帕肽20与40 μg· d-1组患者腰椎骨密度分别增加了5.9%与9.0%(与安慰剂组相比P<0.001),股骨颈骨密度增加了1.5%(P=0.029)和2.9%(P<0.001),同时观察到40 μg· d-1组不良反应高于20μg· d-1组。后续研究中将其中350例男性骨质疏松症患者继续观察30 ~ 42个月,发现特立帕肽组椎体骨折发生率较安慰剂组降低51%。目前临床常用治疗糖皮质激素诱导的继发性骨质疏松症药物包括双磷酸盐和降钙素类。观察428例糖皮质激素诱导的骨质疏松症患者(每日服用泼尼松剂量≥5 mg,时间≥ 3个月),214例给予特立帕肽20 μg· d-1,214例给予阿仑膦酸钠10 mg· d-1,治疗6个月后两组腰椎骨密度增加幅度即出现统计学显著差异,且特立帕肽组腰椎骨折发生率明显低于阿仑膦酸钠组,但至少有1次血清钙测量值升高的患者,在特立帕肽组显著多。因此本品是治疗糖皮质激素继发骨质疏松症极有前景的药物。
药物代谢动力学[2]
特立帕肽皮下注射后吸收及消除速度都很快,皮下注射本品20 μg,达峰时间(tmax)为30 min,半衰期(t1/2 )为60 min,静脉注射血清半衰期为5 min,绝对生物利用度95%。90%药物经肾脏清除。目前进行的临床研究多以皮下注射为给药方式。对10 名健康受试者比较肺部给药1 600 IU与皮下注射400 IU在达峰时间与峰浓度的差异,结果表明,肺部给药达峰时间为(10 ±5)min,快于皮下注射给药达峰时间(28 ±8)min;肺部给药峰浓度为(309 ±215)pmol· L-1,高于皮下注射给药峰浓度(102 ±45)pmol· L-1,生物利用度为48%,因此认为肺部给药是有效的,也是有可能代替皮下给药的途径之一。Nastech制药公司研发的人甲状旁腺激素鼻喷剂PTH(1-34)目前已进入Ⅱ期临床试验,其生物利用度与皮下注射特立帕肽相似。
不良反应与安全性[2]
特立帕肽注射后常见不良反应包括头晕、背痛、恶心和下肢痉挛等,多为一过性;少见的不良反应包括心律失常、耳聋等。目前认为不良反应发生与患者年龄和给药剂量之间无明显关系。在大鼠研究中发现特立帕肽使骨肿瘤如骨肉瘤发生率增加,并且肿瘤发生与给药剂量与治疗持续时间相关。但美国FDA认为大鼠实验模型并不能真实代表人体研究的结果,该药于2002年12月获FDA批准上市。在上市后进行的为期3年的前瞻性的临床研究,并未发现使用特立帕肽使患者骨肿瘤发病率有所增加。但是目前仍建议在应用特立帕肽时,具有骨肉瘤潜在危险性的对象如Paget骨病、骨骼放疗史的患者应避免应用。总结了该药上市5年来相关安全性的报道以及自身应用的临床经验,还发现特立帕肽可引起一过性血钙升高、高尿钙和高尿酸血症,但发生率与安慰剂组比较无显著性差异。内源性PTH在特立帕肽每天1次20 μg皮下注射给药后立即出现了持续急剧下降,考虑可能是特立帕肽抑制了甲状旁腺释放内源性PTH,并认为其氨基端也可能参与了这个负反馈。当停药6个月后内源性PTH水平较用药时上升。因此认为内源性PTH可作为特立帕肽用药监测的选择性指标。长期超生理剂量PTH对骨吸收作用大于骨形成,因此寻找治疗骨质疏松症的剂量尤为重要。虽然多数临床研究均证明本品增加骨密度作用呈剂量依赖性增加,但是考虑安全性与不良反应的因素,目前临床常用的剂量为20 μg· d-1,并建议使用时间一般不超过2年。
制备[1]
醋酸立特帕肽制备如下:
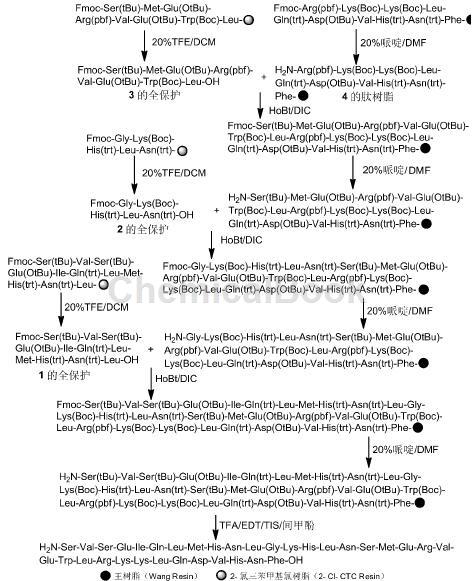
( 1) 4 的肽树脂的合成
Fmoc-Phe-Wang Resin 的制备: 将Wang Resin15.0 g 加入多肽合成反应柱中,加入DMF 100mL,溶胀30 min; 抽滤,除去滤液。在烧杯中加入Fmoc- Phe-OH 5.8 g( 15 mmol) 、1-羟基苯并三唑( HoBt) 2.4 g( 18 mmol) 和DMF 90 mL,搅拌使其溶解; 冰浴冷却15 min,加入N,N-二异丙基碳二亚胺( DIC) 2.8 mL( 18 mmol),冰浴活化2 ~ 8 min后加入反应柱中,于30 ℃反应15 min。缓慢滴加4-二甲氨基吡啶( DMAP) 0.18 g ( 1.5 mmol) 的DMF( 10 mL) 溶液,滴毕,反应2 h。除去液体,用DMF( 3 × 30 mL) 洗涤,加入封闭液( 醋酐/吡啶=20 /5,V /V) 100 mL,封闭5 h。除去液体,依次用DMF( 5 × 20 mL) 和MeOH( 3 × 30 mL) 洗涤( 每次10 min),抽干树脂,真空干燥过夜得Fmoc-Phe-Wang Resin 18.6 g,替代度[11]0.32 mmol·g - 1。肽链的延伸: 将Fmoc-Phe-Wang Resin 15.6 g( 5 mmol) 加入反应柱中,根据Fmoc 固相多肽合成原理,以HoBt /DIC 为缩合体系,DMF 为反应溶剂,按2 eq.投料,依次缩合Fmoc-Asn ( trt) -OH、Fmoc-His( trt) -OH、Fmoc- Val-OH、Fmoc-Asp( Ot-Bu ) -OH、Fmoc-Gln ( trt ) -OH、Fmoc-Leu-OH、Fmoc-Lys ( Boc ) -OH、Fmoc-Lys ( Boc ) -OH 和Fmoc-Arg( pbf) -OH,缩合过程中使用Kaiser 法判断反应终点,最终得4 的肽树脂28.6 g; MS( ESI) m/z: 1 285.6{ [M + H]+ } 。
2)3 的全保护肽的合成
Fmoc-Leu-CTC Resin 的制备: 将2-Cl-CTC 树脂20 g( 1.0 mmol·g - 1 ) 加入多肽合成反应柱中,加入DMF 150 mL,溶胀30 min; 抽滤,除去滤液。在烧杯中加入Fmoc-Leu-OH 14.1 g( 40 mmol) 和DMF 100 mL,搅拌使其溶解; 加入N,N-二异丙基乙胺( DIPEA) 21 mL( 120 mmol),混合均匀后于30 ℃反应2 h。滤除液体,用DMF( 3 × 30 mL) 洗涤,加入封闭液( DCM/MeOH/DIPEA = 17 /2 /1,V /V /V) 100 mL,封闭两次,每次10 min,依次用DMF( 5 × 20 mL) 和MeOH( 3 × 30 mL) 洗涤,每次10 min,抽滤,真空干燥过夜得Fmoc-Leu-CTCResin 28.7 g,替代度0.74 mmol·g - 1。肽链的延伸: 用类似的方法依次缩合Fmoc-Trp( Boc) -OH、Fmoc-Glu( OtBu) -OH、Fmoc-Val-OH、Fmoc-Arg( pbf) -OH、Fmoc-Glu( OtBu) -OH、Fmoc-Met-OH 和Fmoc-Ser ( tBu ) -OH 得肽树脂45.8 g。全保护肽裂解: 将肽树脂45.8 g 加入裂解液( 20%TFE /DCM) 360 mL 中,裂解2 h。抽滤,滤饼重复抽滤,合并滤液,旋蒸得3 的全保护肽31.8 g,纯度94.2%; MS( ESI) m/z: 1 273.5{ [M+ H]+ } 。
3) 的全保护肽的合成
Fmoc-Asn( trt) -CTC Resin 的制备: 将2-Cl-CTC 树脂20 g( 1.0 mmol·g - 1 ) 加入多肽合成反应柱中,加入DMF 150 mL 溶胀; 抽滤,除去滤液。在烧杯中加入Fmoc-Asn ( trt ) -OH 23.9 g ( 40mmol) 和DMF 100 mL,搅拌使其溶解; 加入DIPEA 21 mL( 120 mmol),混合均匀后加入反应柱中,于30 ℃反应2 h。滤除液体,用DMF( 3 ×30 mL) 洗涤,加入封闭液( DCM/MeOH/DIPEA =17 /2 /1,V /V /V) 100 mL,封闭两次,每次10 min,依次用DMF( 5 × 20 mL) 和MeOH( 3 × 30 mL) 洗涤,每次10 min,抽干树脂,真空干燥过夜得Fmoc-Asn( trt) -CTC Resin 27.2 g,替代度0.57mmol·g - 1。 肽链的延长: 将Fmoc-Leu-CTC Resin 26.3 g( 15 mmol) 加入反应柱中,用类似的方法依次缩合Fmoc-Leu-OH、Fmoc-His ( trt ) -OH、Fmoc-Lys( Boc) -OH 和Fmoc-Gly-OH 得肽树脂39.8 g。全保护肽裂解: 将肽树脂39.8 g 加入裂解液( 20%TFE /DCM) 320 mL 中,裂解2 h。抽滤,滤饼再次抽滤,合并滤液,旋蒸除溶得2 的全保护肽24.8 g,纯度93.6%; MS ( ESI ) m/z: 792.3。
4)1 的全保护肽的合成
Fmoc-Leu-CTC Resin 的制备: 用类似1.2( 2)的方法制得Fmoc-Leu-CTC Resin 27.8 g,替代度0.69 mmol·g - 1。肽链的延长: 将Fmoc-Leu-CTC Resin 21.7 g( 15 mmol) 加入反应柱中,用类似的方法依次缩合Fmoc-Asn( trt) -OH、Fmoc-His( trt) -OH、Fmoc-Met-OH、Fmoc-Leu-OH、Fmoc-Gln ( trt ) -OH、Fmoc-Ile-OH、Fmoc-Glu ( OtBu ) -OH、Fmoc-Ser( tBu) -OH、Fmoc-Val-OH 和Fmoc-Ser ( tBu) -OH得片段肽树脂59.3 g。
全保护肽裂解: 将肽树脂59.3 g 加入到裂解液( 20% TFE /DCM) 480 mL 中,裂解2 h。抽滤,滤饼再次抽滤,合并滤液,旋蒸除溶得1 的全保护肽40.6 g,纯度90.1%; MS( ESI) m/z: 1 494.9。
5)特立帕肽的合成
特立帕肽肽树脂合成: 将4 的肽树脂28.6 g( 5 mmol) 加入反应柱中,加入DMF 200 mL,溶胀30 min; 按照Fmoc 固相多肽合成原理,以HoBt /DIC 为缩合体系,20% 哌啶/DMF 溶液为脱保护试剂,DMF 为反应溶剂,2 eq.投料量,于30 ℃依次偶联1 ~ 3 的全保护肽,偶联3 h。茚检若呈阳性,补加1 eq.投料至茚检呈阴性。最后在以20% 哌啶/DMF 溶液脱除整个肽链氨基端的Fmoc 得特立帕肽肽树脂56.2 g。特立帕肽粗品的制备: 将特立帕肽肽树脂56.2 g( 5 mmol) 加入裂解液( TFA/EDT /TIS /间甲酚= 92.5 /2.5 /2.5 /2.5,V /V /V /V( 450 mL) 中,裂解2.5 h。抽滤,滤饼用TFA( 2 × 100 mL) 洗涤,合并滤液和洗液( 670 mL),加入冰异丙醚4L,沉降,离心,弃上清液,用异丙醚( 3 × 300 mL)洗涤,真空干燥过夜得特立帕肽粗品29.6 g。特立帕肽纯品制备: 将特立帕肽粗品29.6 g( 5 mmol) 溶解于纯水( 2.5 L) 中,于40 ℃搅拌至HPLC 检测双峰消失,再经制备型P-HPLC 纯化,收集、合并纯度大于99% 的样品,用醋酸铵脱盐后,浓缩、冻干得纯品特立帕肽6.8 g。
主要参考资料
[1] CN201510295556.2 一种合成特立帕肽的方法
[2] 特立帕肽治疗骨质疏松症的应用进展
[3] 片段法合成抗骨质疏松多肽药物特立帕肽
