(1)关于氨水的密度
首先看一道试题,“含氨量35%(质量分数)的氨水密度为0.880 g/ml,那么NH3的体积摩尔浓度是多少?”
解答:假设氨水总量为1000 mL,那么NH3的质量为1000×0.35=350 g/1000 ml,所以NH3的摩尔数为350/17=18.01 mol,所以NH3的体积摩尔浓度是18.01 mol/L。
从这个题里面可以获得以下信息,NH3的摩尔数是18.01mol,那么其标况下的体积为403L,而这部分NH3溶于水后整体的体积只有1L,也就是说氨水的体积并不是NH3的体积与水的体积之和。同样,氨水的体积也不可能单纯是水的体积,因为如果单纯是水的体积的话,在体积不变的情况下质量增加,氨水密度不可能为1。因此NH3溶于水后,氨水的体积应该是介于水的体积、NH3和水的体积之和两者之间。
那么为什么氨水的体积增加会较NH3溶于水的质量增加还要大呢?原因是NH3溶于水之后会形成氢键,氢键的存在使得NH3溶于水后水的体积增大,类似于两者之间形成一种架构,把整个分子的体积扩充起来,密度减小。NH3分子与水分子具有相近的键角(bond angle,H2O的键角为105°,NH3的键角为107°)及电子组态(electron configuration),NH3和水在很多反应中具有相似之处。
关于氢键,网上的解答如下“由于N(或O)与H只能形成共价化合物,但N(或O)对电子的吸引力比较强,使H具有一定正离子的性质,而N(或O)具有一定阴离子的性质;于是,NH3里的N将吸引水的H,水里的O将吸引NH3里的H,这样就形成了一种特殊的键——氢键;而且氢键只存在于N/O/F三种元素的氢化物中。"
而关于NH3的分子量为17,H2O的分子量为18,所以氨水的密度小于水这样的阐述是不正确的,因为这样的原理只适用于气体(理想气体);关于液氨浓度比水小(0℃时液氨密度为0.638 g/cm3),所以氨水密度小于水的说法也不完全正确,因为氨水的制备是通过NH3溶于水制得的。
(2)关于计算理论脱硝氨水用量时的基准是用一水合氨(NH3·H2O)还是NH3?
首先可以肯定的是,NH3溶于水中会存在三种分子形态,即NH3·H2O、NH3和H2O分子,至于其中NH3·H2O的量有多少,取决于NH3溶于水后相关反应的平衡常数。例如,18℃下Kb = [NH4+][OH−]/[NH3] = 1.75×10-5。
在此不想追究NH3·H2O到底有多少。需要说明的是企业一般讲的氨水浓度20%-25%,指的NH3含量20%-25%,国家标准规定的检测方法也是针对NH3量的检测,而不是NH3·H2O的检测,因此计算理论脱硝用氨水用量时应该根据NH3的量来计算,而不是NH3·H2O。
具体俩说,假设某水泥窑标况气体量为30万Nm3/h,脱硝前NO2浓度(按国标折算后)为800 mg/Nm3,脱硝后为400 mg/Nm3(当然现在控制400的厂家已经很少了),求解SNCR脱硝理论氨水用量为多少?
解答:对于NO2来讲,每消耗一个NO2分子,需要消耗2个NH3分子,两者反应方程式如下:
4NH3+2NO2+O2=3N2+6H2O
首先计算NO2减排的摩尔数:302608.70000*(800-400)/1000/46=2608.7 mol/h,因此消耗的NH3摩尔数为5217.4 mol/h,对应的NH3量为88.7 kg/h,对于NH3含量为20%(质量分数)的氨水,对应的氨水用量为443.5 kg/h,由于20%氨水的密度在常温下为0.92 g/cm3,因此氨水体积用量为482 L/h。
大部分SNCR脱硝的氨氮摩尔比(NSR)为1.5-2.0,意味着氨水体积用量要乘以1.5-2.0,即为723-964 L/h。
(3)关于氨水的颜色
即使有些氨水呈现淡黄色,这也是符合国家标准规定的。化学工业部关于氨水的标准有如下规定:
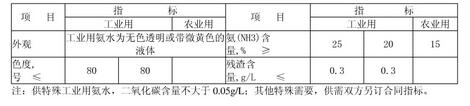
可以看出,即使带微黄色的氨水也是符合国家规定的。为什么会呈现微黄色呢?是因为生产过程中引入铁离子等杂志而引起的。
