铁氰化钾是一种无机化合物,化学式为K3[Fe(CN)6],俗称赤血盐。该亮红色固体盐含有[Fe(CN)6]3−配离子。它可溶于水,水溶液带有黄绿色荧光。

制备
铁氰化钾是用氯气氧化亚铁氰化钾溶液制备的:
2K4[Fe(CN)6] + Cl2 → 2K3[Fe(CN)6] + 2KCl
化学性质
铁氰化钾在封闭管中灼烧,产生氰化钾并放出氰气:
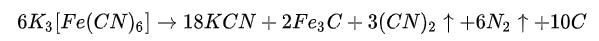
或者直接被碱还原:
4 K3[Fe(CN)6] + 4 KOH(浓) —△→ 4 K4[Fe(CN)6] + O2↑ + 2 H2O
13 K3[Fe(CN)6] + 9 KOH + 6 H2O → Fe(OH)3 + 12 K4[Fe(CN)6] + 6 NH3↑ + 6 CO2↑
和金属盐溶液反应
铁氰化钾另一重要性质源于其铁氰酸根([Fe(CN)6]3-),它可以与不同的金属离子结合:
[Fe(CN)6]3- + Fe3+ → Fe[Fe(CN)6](暗棕色)(aq)
2 [Fe(CN)6]3- + 3 Fe2+ → Fe3[Fe(CN)6]2↓(深蓝色)
2 [Fe(CN)6]3- + 3 Co2+ → Co3[Fe(CN)6]2↓(红色)
2 [Fe(CN)6]3- + 3 Cd2+ → Cd3[Fe(CN)6]2↓(橙色)
2 [Fe(CN)6]3- + Mn2+ + 4 OH- → 2 [Fe(CN)6]4- + MnO2 + 2 H2O
2 [Fe(CN)6]3- + 3 Cu2+ → Cu3[Fe(CN)6]2↓(红棕色)
[Fe(CN)6]3- + 3 Ag+ → Ag3[Fe(CN)6]↓(橙色)
需要注意的是,稀铁氰酸钾和Ca2+、Ba2+无作用。
氧化性
铁氰化钾在碱性溶液中是强氧化剂。如被被过氧化氢还原:
2 K3[Fe(CN)6] + H2O2 + 2 KOH → 2 K4[Fe(CN)6] + O2↑ + 2 H2O
碘化物、硫化物等还原性物质也能将铁氰酸钾还原,产生亚铁氰酸钾,自身则被氧化为碘、硫,如:
2 K3[Fe(CN)6] + 2 KI → 2 K4[Fe(CN)6] + I2
除此之外,铁氰化钾可以发生如下反应:
14 K3[Fe(CN)6](5%,热) + 3 I2 → 2 Fe4[Fe(CN)6]3 + 42 KCN + 6 CNI
它可以氧化很多有机物。
用途
铁氰化钾用于蓝图印刷术及摄影的卡罗法中,也可在有机合成中作温和氧化剂。
铁氰化钾与酚酞混合得到铁锈指示剂,遇到Fe2+离子会变蓝(普鲁士蓝),可用于检测金属的氧化程度。用色度计分析深蓝色的Fe4[Fe(CN)6]3,可以算出起始的Fe2+离子莫尔数。
生理学实验中用铁氰化钾来提高溶液的氧化还原电势(Eo' ~ 436 mV, pH 7),常以连二亚硫酸钠作还原剂(Eo' ~ −420 mV, pH 7)。
实验室中通常用铁氰化钾作为铁的来源,使鲁米诺发光。
