背景及概述[1] [2] [3]
吲哚胺2,3-双加氧酶1(indoleamine2,3-dioxygenase1,IDO1)是L-色氨酸沿犬尿氨酸途径代谢的关键酶,是潜在的肿瘤免疫治疗药物靶点。目前已有至少10个IDO1小分子抑制剂进入临床研究。本文将根据化合物的结构类型,对代表性IDO1小分子抑制剂的结合模式和构效关系进行综述,希望能够对IDO1小分子抑制剂的研究提供启示。
吲哚胺2,3-双加氧酶1(IDO1)的结构[1]
2006年,IDO1复合物的晶体结构(2D0T、2D0U)首次被报道,揭示了IDO1蛋白结合腔的特征,为理性分子设计提供了依据。IDO1是一种含亚铁血红素的双加氧酶,包括两个结构域。其中大的结构域是由13个α-螺旋(G-S)和两个310螺旋组成的全螺旋结构域。4个长螺旋(G、I、Q、S)与血红素平面大致平行,并与其他3个短螺旋(K、L、N)共同构成了血红素结合口袋(图1A)。
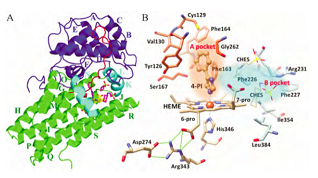
图1A和图1B
螺旋Q中的His346的咪唑是血红素中铁离子的内源性配体,在第五配位位置与铁离子络合(图1B)。小的结构域在血红素的远侧,由6个α-螺旋(A~F)、两个短β-折叠和3个310螺旋构成,位于血红素铁离子第六配位位置的上方,覆盖血红素口袋的顶部(图1A)。由IDO1复合物的晶体结构(图1B)可以看出,IDO1结合腔包括A、B两个结合口袋,其中A腔位于铁离子第六配位位置上方,是由Ala264、Gly262、Tyr126、Val130、Cys129、Phe163和Phe164等氨基酸构成的疏水性口袋,B腔位于开口处,由Phe226、Phe227、Arg231、Ile354和Leu384等氨基酸构成。
氨基酸突变实验表明,His346、Asp274、Phe226、Phe227、Arg231是IDO1蛋白的关键氨基酸,与蛋白的稳定性、催化活性和底物识别有关。研究发现当将Asp274突变成Ala时,会影响IDO1的催化活性[5],这是由于Asp274与Arg343形成盐桥,而Arg343位于血红素卟啉环附近与6位丙酸基形成氢键从而稳定血红素。Phe226、Phe227、Arg231通常与配体形成π-π或者阳离子-π相互作用,从而对IDO1的催化活性和底物识别产生影响。Ser167Ala的突变实验表明,Ser167既不位于底物识别区,也不会影响酶的催化活性[4],然而许多晶体结构都证实,Ser167会与配体形成氢键作用,是IDO1结合口袋的关键氨基酸[6,7]。
生物学功能[1]
IDO1是色氨酸沿犬尿氨酸途径代谢的限速酶,是代谢途径的步。如图2所示,在IDO1的催化下,色氨酸中吡咯环发生氧化裂解,生成N-甲酰犬尿氨酸,经犬尿氨酸甲酰胺酶去甲酰化生成犬尿氨酸,在犬尿氨酸酶的催化裂解下生成邻氨基苯甲酸,随即转化为2-氨基黏康酸、2-吡啶甲酸和喹啉酸,喹啉酸在磷酸核糖转移酶的作用下生成NAD+。IDO1通过催化色氨酸的氧化裂解反应,调控体内色氨酸及代谢产物的水平,发挥着重要的生物学功能。
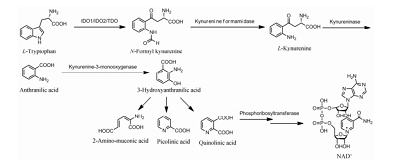
图2 IDO1的催化
肿瘤免疫治疗[2]
肿瘤免疫治疗通过重新启动肿瘤中的免疫细胞,恢复机体正常的抗肿瘤免疫反应来抑制肿瘤发展,是近年来肿瘤领域革命性的突破。但以免疫检查点抑制剂为代表的免疫治疗药物一直存在着响应率低的问题,很大程度上限制了这一疗法的应用。IDO1抑制剂的发展使得免疫治疗应答率有了大幅度的改善,助力研究人员在攻克癌症的道路上加速前行。相信随着基础研究的继续深入和临床试验的同步结合IDO1相关研究成果会为更多的肿瘤患者带来希望。
参考文献
[1] 杜婷婷,来芳芳,陈晓光.吲哚胺2,3-双加氧酶1在肿瘤免疫治疗中的研究进展[J].药学学报,2018,53(08):1272-1279.
[2] 张心苑,崔国楠,徐柏玲.吲哚胺2,3-双加氧酶IDO1抑制剂的研究进展[J].药学学报,2018,53(11):1784-1796.
[3] 张曼,刘思言,赖唐敏,等.新型吲哚胺2,3-双加氧酶1抑制剂的合成及活性研究[J].中国药物化学杂志,2018,28(01):8-14.
