简介
7-溴吲哚是重要的医药中间体。常作为起始原料,经过傅克反应、酞胺化、还原、叔丁氧挨基保护反应得到目标产物。7-溴吲哚与各种芳基硼酸的偶联通过Suzuki反应进行。提供了良好的产率,并被发现适于放大至10-20克所需芳基吲哚产物。这种交叉偶联方法的主要优点是不需要吲哚官能化或氮保护[1]。
合成
![图1 7-溴吲哚的合成路线[2]。 图1 7-溴吲哚的合成路线[2]。](/NewsImg/2023-02-02/6381094583049654217192119.jpg)
图1 7-溴吲哚的合成路线[2]。
将1-溴-2-硝基苯(6.00 g)和THF(180 mL)装入配备PTFE涂层搅拌棒的500 mL圆底烧瓶中。将生成的亮黄色溶液冷却至-45°C。在10分钟内加入1.0 M THF乙烯基溴化镁溶液(90 mL,90 mmol,3当量)。保持内部温度≤-40°C,以产生橙色溶液。添加完成后将反应混合物在-45°C下老化25分钟。将反应混合物倒入饱和NH4Cl水溶液(200mL)中。用Et2O(5 x 75 mL)萃取反应混合物。用MgSO4干燥合并的有机层。真空浓缩合并的有机层。将所得残留物进行柱色谱(己烷∶EtOAc=9:1)。继续在500 mL圆底烧瓶中加入1-溴-2-硝基苯(6.00 g,29.70 mmol,1当量;FW=202.01)和THF(180 mL)。将得到的亮黄色溶液冷却至-45°C。然后在10分钟内加入1.0M乙烯基溴化镁THF溶液(90mL,90mmol,3当量),同时仔细监测反应混合物的内部温度。(由于反应非常放热,因此必须调整添加速率,使内部温度不超过-40°C。)在添加溴化乙烯镁的过程中,颜色从亮黄色变为橙色。添加完成后,将反应混合物在-45°C下再搅拌25分钟。处理:将反应混合物倒入饱和NH4Cl水溶液(200mL)中,并用Et2O(5 x 75mL)萃取。然后将合并的有机层用MgSO4干燥并真空浓缩。纯化:在具有以下财产的柱上对粗产物进行柱色谱(己烷:EtOAc=9:1):直径=5.0 cm,填充长度=30 cm,粒径=45 mL。产物为淡黄色晶体7-溴吲哚:4.17 g(72%)。7-溴-1H-吲哚(S-2),产率4.17g(72%)。M、 p.=43-44°C(点燃3 43-44°)。合成路线如图1所示。
![图2 7-溴吲哚的合成路线[3]。 图2 7-溴吲哚的合成路线[3]。](/NewsImg/2023-02-02/6381094585988505473613803.jpg)
图2 7-溴吲哚的合成路线[3]。
将7-borylidol(1.00 mmol)溶于甲醇(12 mL)中。将CuBr2(670 mg,3.00 mmol,3.00当量)溶解在H2O(12 mL)中。向MeOH溶液中加入CuBr2水溶液。在80°C下加热混合物4小时。将反应混合物冷却至室温。用Et2O稀释混合物。分离图层。用Et2O萃取水层。用盐水洗涤合并的有机层。用MgSO4干燥合并的有机层。过滤合并的有机层。在真空下浓缩合并的有机层。通过柱色谱(80:20己烷:乙酸乙酯)纯化残余物得到7-溴吲哚。合成路线如图2所示。
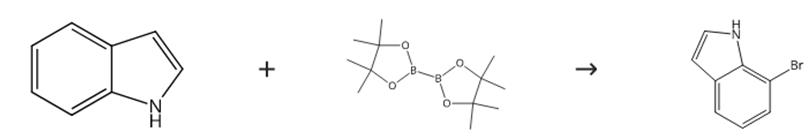
图3 7-溴吲哚的合成路线。
向手套箱内的干燥小瓶中加入[Ru(对cymene)Cl2]2(6.0 mg,0.010 mmol,0.010当量)、吲哚(117 mg)、二乙基硅烷(132 mg,1.50 mmol,1.50当量)和甲苯(0.5 mL)。在室温下搅拌混合物2小时,通过GC监测吲哚完全转化为N-甲硅烷基吲哚。在真空下除去挥发性物质。向小瓶中加入[Ir(cod)Cl]2(1.7 mg,0.0025 mmol,0.0025当量)、dtbpy(1.4 mg,0.0050 mmol,0.005当量)、B2pin2(1.00 mmol)、HBpin(0.008 mL,0.05 mmol,0.05当量)和THF(1 mL)。在80°C下加热反应混合物。4小时后,通过GC监测N-二乙基甲硅烷基吲哚的完全转化。将反应混合物冷却至室温。在40°C的高真空下从反应混合物中除去挥发性物质。将反应混合物溶解在2 mL THF中。向混合物中加入0.5mL 3M NaOAc(水溶液)。在室温下搅拌混合物6小时。脱硅完成后,用Et2O和H2O稀释反应混合物。分离水层。用Et2O萃取水层。用盐水洗涤合并的有机层。用MgSO4干燥有机层。过滤有机层。在真空下浓缩有机层。通过柱色谱(85:15己烷:乙酸乙酯)纯化残留物7-溴吲哚。合成路线如图3所示。
用途
7-溴吲哚多作为糖基化试剂参与多种有机反应。例如: 7-溴吲哚与芳基乙基哌嗪的氨基羰基化提供了CNS活性苯丙胺衍生物。其成功地进行了钯催化的无保护溴吲哚的羰基化反应[4]。
参考文献
[1] 不公告发明人. 一种7-溴吲哚衍生物的制备方法[P]. 湖南:CN107286073A,2017-10-24.
[2] G.M. Carrera, G.S. Sheppard, SYNTHESIS OF 6-ARYLINDOLE AND 7-ARYLINDOLE VIA PALLADIUM-CATALYZED CROSS-COUPLING OF 6-BROMOINDOLE AND 7-BROMOINDOLE WITH ARYLBORONIC ACIDS, SYNLETT (1) (1994) 93-94.
[3] Marzabadi, Mohammad R.; et al. Preparation of substituted anilinic piperidines as MCH selective antagonists. United States, US6727264 B1 2004-04-27.
[4] Marineau, Jason J.; et al. Preparation of inhibitors of cyclin dependent kinase 7 (CDK7). World Intellectual Property Organization, WO2018013867 A1 2018-01-18.
[5] K. Kumar, A. Zapf, D. Michalik, A. Tillack, T. Heinrich, H. Bottcher, M. Arlt, M. Beller, Palladium-catalyzed carbonylation of haloindoles: No need for protecting groups, ORGANIC LETTERS 6(1) (2004) 7-10.
