吡啶和吡啶衍生物是制药和农用化学品中存在的常见含氮杂环化合物。在2020年FDA批准的35种小分子药物中,15种(43%)含有吡啶杂环类结构。最近以2-溴-5-氯吡啶为原料合成出许多活性物质,有广阔的应用前景。
药物合成中的应用
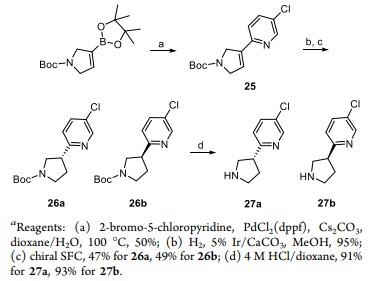
BMS-986224抑制剂的合成
APJ是一种A类G蛋白偶联受体(GPCR),被认为是治疗高血压、动脉粥样硬化、心力衰竭及糖尿病等多种疾病的潜在靶点。百时美施贵宝(BMS)公司开发的具有适合长期口服给药药代动力学特征的小分子APJ受体激动剂,目前已经进入临床I期研究(BMS-986224)。Matthew J. Goldfogel等人开发一种BMS-986224抑制剂的合成策略:
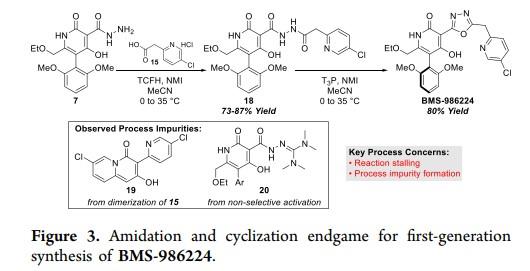
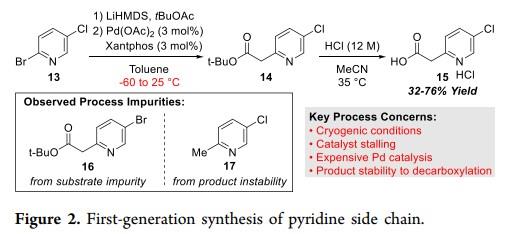
代合成策略中吡啶链的合成如下:合成的吡啶侧链15是通过2-溴-5-氯吡啶13和乙酸叔丁酯的两步串联(图2)。乙酸叔丁酯在低温条件下与LiHMDS的去质子化反应以及随后钯催化的2-溴吡啶13交叉偶联生成14。[1]
百时美施贵宝(BMS)制药公司研究人员继续研究,发现羧酰胺在吡啶酮核的C3和各自吡啶酮核的C5处作为恶二唑生物异位体的构效关系。鉴定出结构分化的6-羟基嘧啶-4(1H)-1-3-羧酰胺14a,其药效学效果与化合物1(BMS-986224)相当。[2]

同样,合成的吡啶侧链是通过2-溴-5-氯吡啶为原料进行合成:
PF-06273340的合成
辉瑞科学家David C. Blakemore开发了用于治疗疼痛的强效、选择性和外周限制性泛原肌凝蛋白相关激酶(Trk)抑制剂PF-06273340的合成策略。生物学证据表明,酪氨酸激酶受体的Trk家族是重要的疼痛靶点。David C. Blakemore团队并实现了PF-06273340的公斤级规模合成。合成路线如下[3]
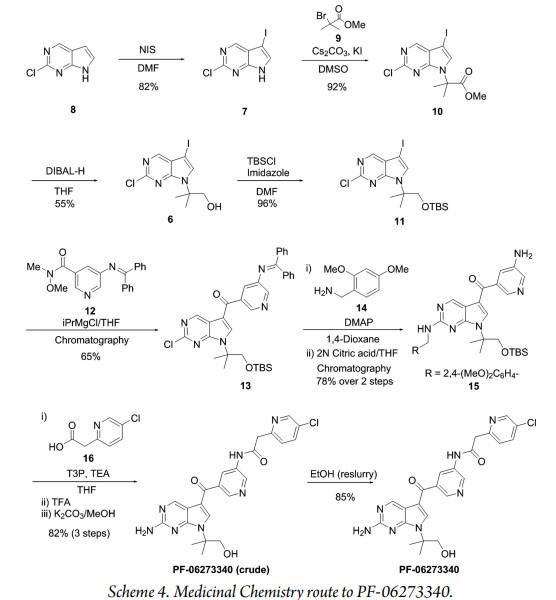
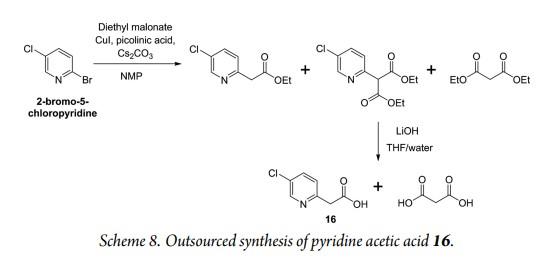
最后一个关键的定制起始原料是吡啶乙酸16,分别交付4.8 kg和11.7kg用于个和第二个API系列。该合成从2-溴-5-氯吡啶开始,与丙二酸二乙酯反应后,由于最初形成的产物部分脱羧,产生了产物的混合物。这不重要,因为在酯水解时,两种中间产物都产生所需的吡啶乙酸16。两个步骤的总收率为38%。
5-氯-7-氮唑酮的合成
Roman S. Alekseyev等人在聚磷酸费舍尔反应的基础上,报道了一种简单有效的合成方法,含有5-chloro-1Н-pyrrolo[2,3-b]吡啶体系的未知杂环结构。该方法可用于以烷基和芳基为取代基的3-取代和2,3-二取代5-氯-7氮唑的合成。5-氯-7-氮唑酮,该类化合物具有抗菌作用,并作为aurora A4和B激酶的抑制剂,这些激酶对细胞有丝分裂至关重要。合成路线如下:[4]
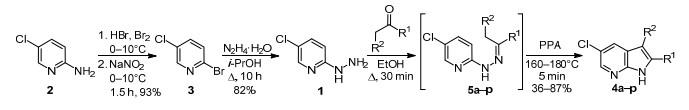
起始以市售且价格低廉的5-氯-2-肼基吡啶(1)基础上合成2-氨基-5氯吡啶(2),(2)通过重氮反应将氨基与溴原子取代,生成2-溴-5-氯吡啶(3),然后将溴原子亲核取代肼基。
咪唑[5,1-f][1,2,4]三嗪的合成
咪唑[5,1-f][1, 2, 4]三氮杂是PDE2的选择性抑制剂。该类化合物对某些中枢神经系统(CNS)或其他疾病有作用。如生殖或精神障碍,包括精神病,认知障碍、精神分裂症、抑郁症、痴呆等其他疾病。Moustafa A. Gouda综述咪唑[5,1-f][1,2,4]三嗪-4(3H)-及其类似物的合成策略,其中一化合物合成如下:[5]
![咪唑[5,1-f][1,2,4]三嗪的合成.jpg 咪唑[5,1-f][1,2,4]三嗪的合成.jpg](/NewsImg/2023-04-16/6381728516617811156552600.jpg)
用1-溴-4-氯苯加热223、224a;2-溴-5-氯吡啶224b或2-溴-5-(三氟甲基)吡啶224c在二恶烷中存在碳酸钾和烯丙基钯氯二聚体在102℃下反应36小时得到相应的反应咪唑[5,1-f][1,2,4]三嗪225a-c(方案40)。
2-溴-5-氯吡啶的制备
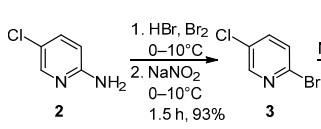
2-溴-5-氯吡啶(3):将溴(26 ml, 0.52 mol)加入到2-氨基-5-氯吡啶(2)(25.6g, 0.2 mol)的48% HBr溶液(100ml, 1.2mol)中,温度<10℃。然后,在相同温度下,将亚硝酸钠(32.4 g, 0.47 mol)溶液加入水中(50 ml) ,1小时添加完成后,将反应混合物再搅拌30分钟,然后用NaOH(74.6 g, 1.86 mol)水溶液(100 ml)以不超过20-25℃的温度处理。将得到的沉淀物过滤掉,用NaHSO3饱和溶液(5 ml)洗涤,冰水(3×30 ml)多次洗涤,风干。产量35.6克(93%),米色粉末,Mp 67-68°С(己烷)(Mp 68-69°С)。Rf-0.4(CHCl3)。[4]
参考文献
[1] Goldfogel, M. J.; Jamison, C. R.; Savage, S. A.; Haley, M. W.; Mukherjee, S.; Sfouggatakis, C.; Gujjar, M.; Mohan, J.; Rakshit, S.; Vaidyanathan, R. Development of Two Synthetic Approaches to an APJ Receptor Agonist Containing a Tetra-ortho-Substituted Biaryl Pyridone. Org. Process Res. Dev. 2022, 26, 624– 634.
[2] Pi, Z.; Johnson, J. A.; Meng, W.; Phillips, M.; Schumacher, W. A.; Bostwick, J. S.; Gargalovic, P. S.; Onorato, J. M.; Generaux, C. N.; Wang, T.; He, Y.; Gordon, D. A.; Wexler, R. R.; Finlay, H. J. Identification of 6-Hydroxypyrimidin-4(1H)-one-3-carboxamides as Potent and Orally Active APJ Receptor Agonists. ACS Med. Chem. Lett. 2021, 12 (11), 1766– 1772.
[3] Blakemore, David C., et al. "The Discovery and Chemical Development of PF-06273340: A Potent, Selective, and Peripherally Restricted Pan-Trk Inhibitor for Pain." Complete Accounts of Integrated Drug Discovery and Development: Recent Examples from the Pharmaceutical Industry Volume 2. American Chemical Society, 2019. 155-183.
[4] Alekseyev, Roman S., Sabina R. Amirova, and Vladimir I. Terenin. "Synthesis of 5-chloro-7-azaindoles by Fischer reaction." Chemistry of Heterocyclic Compounds 53 (2017): 196-206.
[5] Gouda, Moustafa A. "Recent Advances in Imidazo [5, 1-f][1, 2, 4] triazin-4 (3H)-ones Chemistry: An Overview of the Synthetic Routes to Vardenafil and Its Analogues." Journal of Heterocyclic Chemistry 55.3 (2018): 564-585.
