背景[1-3]
人肝内胆管上皮细胞提取于人肝脏组织,于原代末期冻存。此细胞通过Cytokeratin-18,-19 and Vimentin免疫荧光染色验证,经测试不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌。细胞可以达到15倍增。
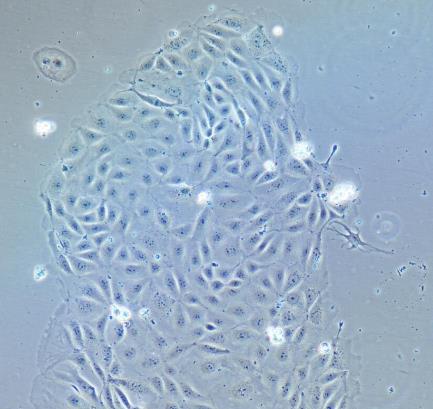
人肝内胆管上皮细胞
内胆管上皮细胞排列成肝内胆管树,在肝脏中形成不同直径的三维管道网。它们仅由3-5%的肝脏细胞组成,但每天产生的胆汁能多达总量的40%。大量研究表明,肝内胆管上皮细胞通过控制激素调控的分泌和吸收,在保持、调整和扩大胆小管的结构中发挥重要作用。肝内胆管上皮细胞在先天性和获得性免疫应答方面起着积极作用。比如:肝内胆管上皮细胞分泌趋化因子和细胞因子,通过表达重要的细胞粘附分子使免疫反应局部化。一般情况下,肝内胆管上皮细胞通过有丝分裂增值。然而,在某些条件下,肝内胆管上皮细胞会明显增生。
人肝内胆管上皮细胞后,请按照以下方法进行操作:
取出25cm2培养瓶,75%酒精擦拭培养瓶,拆下封口膜,放入37℃,5%CO2细胞培养箱中静置3-4小时以稳定细胞状态,然后换用新鲜人肝内胆管上皮细胞培养液继续培养或进行传代。
2、人肝内胆管上皮细胞传代:
1)细胞生长至覆盖培养瓶的80%面积时,弃25cm2培养瓶中的培养液,用PBS清洗细胞一次;
2)添加0.25%胰蛋白酶消化液约1ml至培养瓶中,倒置显微镜下观察,待细胞回缩变圆后加入人肝内胆管上皮细胞培养液终止消化,再轻轻吹打细胞使之脱落,然后将悬液转移至15ml离心管中,1000rpm离心5min;
3)弃上清,沉淀细胞用12ml人肝内胆管上皮细胞培养基重悬,然后按1:2比例进行分瓶传代,后放入37℃,5%CO2细胞培养箱中培养;
4)待人肝内胆管上皮细胞贴壁后,观察培养结果,之后进行换液培养或传代。
3、细胞冻存:
1)细胞生长至覆盖培养瓶的80%面积时,弃25cm2培养瓶中的培养液,用PBS清洗细胞一次;
2)添加0.25%胰蛋白酶消化液约1ml至培养瓶中,倒置显微镜下观察,待细胞回缩变圆后加入人肝内胆管上皮细胞培养液终止消化,轻轻吹打细胞使之脱落,然后将悬液转移至15ml离心管中,1000rpm离心5min;
3)用适量的冻存液(FBS:DMSO=9:1)重悬细胞,并放置于冻存管中;
4)先将细胞冻存管放置于-20℃1.5h,然后将其移入-80℃过夜,24h后转入液氮中进行长期保存。使用程序降温盒可直接放入-80℃。
4、人肝内胆管上皮细胞复苏:
1)从液氮中取出细胞冻存管,快速将其置入37℃水浴中解冻,直至冻存管中无结晶,然后用75%的酒精擦拭冻存管外壁;
2)将冻存管中的细胞移至含5ml人肝内胆管上皮细胞培养基的15ml离心管中,1000rpm离心5min;
3)弃上清,沉淀用5ml人肝内胆管上皮细胞培养基重悬,接种25cm2培养瓶,于37℃,5%CO2细胞培养箱中培养;
4)第二天,换用新鲜人肝内胆管上皮细胞培养基继续培养。
应用[4][5]
人肝内胆管上皮细胞可以用于LPS通过激活TLR4诱导人肝内胆管上皮细胞上皮—间质转化
研究Toll样受体4(TLR4)在脂多糖(LPS)诱导人肝内胆管上皮细胞(HIB ECs)上皮-间质转化(EMT)中的作用及核转录因子Snail是否与参与该过程的调控。
方法:体外培养人肝内胆管上皮细胞,CON+LPS组加终浓度为2ug/ml的LPS诱导72h,CON组不作处理作为对照。倒置相差显微镜观察细胞形态变化;Real-time PC R检测上皮标记物E-cadherin,间质标记物N-cadherin、Vimentin,TLR4、核转录因子Snailm RNA表达量;Western blot检测以上各指标蛋白表达量;Transwell细胞迁移实验评估各组细胞移动能力。KD+LPS组构建TLR4 si RNA慢病毒载体,采用RN A干扰技术沉默HIBECs中TLR4,NC+LPS组空白病毒转染作为对照,转染72h后分别予终浓度为2ug/ml的LPS诱导,72h后通过上述方法观察慢病毒转染对LPS诱导的细胞形态改变,TLR4、Snail、上皮间质标记物基因表达改变的影响。
结果:1.LPS诱导HIBECs 72h,CON+LPS组细胞由上皮向间叶样细胞形态改变;与CON组相比,CON+LPS组上皮标记物E-cadherin m RNA表达下调(P<0.05),间质标记物N-cadherin、Vimentin m RNA表达上调(P<0.05,P<0.05);上述指标蛋白水平表达趋势与m RNA一致;两组细胞转移率无差异(P>0.05);提示:LPS可诱导HIB ECS发生EMT。
2. CON+LPS组TLR4 m RNA表达量高于CON组(P<0.05);蛋白水平表达前者较高;提示:LPS可导致HIBECs中TLR4表达增加。
3. CON+LPS组Snail m RNA表达量高于CON组(P<0.05);蛋白水平表达前者较高;提示:LPS可导致HIBECs中Snail表达增加。
4. KD+LPS组TLR4 Si RNA慢病毒转染HIBECs,TLR4 m RNA表达量较NC+L PS组降低(P<0.05);蛋白水平表达量前者较低。提示:TLR4Si RNA慢病毒转染能减弱LPS诱导HIBECs中TLR4基因表达上调。
5. 沉默HIBECs中TLR4,KD+LPS组Snail m RNA表达量较NC+LPS组降低(P<0.05)。蛋白水平表达前者较低。提示:沉默TLR4能减弱LPS诱导HIBECs中Sn ail基因表达上调。
6. 沉默HIBECs中TLR4,KD+LPS组细胞由上皮向间叶样细胞形态改变不明显。与NC+LPS组比较,KD+LPS组上皮标记物E-cadherin m RNA表达较高(P<0.05),间质标记物N-cadherin、Vimentin m RNA表达较低(P<0.05,P<0.05)。两组上述指标蛋白水平表达趋势与m RNA表达一致。提示:沉默TLR4能阻断LPS诱导HIBEC s发生EMT。
结论:1.LPS通过激活TLR4诱导HIBEC发生EMT;
2.LPS诱导HIBECs发生EMT可能受转录因子Snail调控。
参考文献
[1]microRNA-21 mediates epithelial-mesenchymal transition of human hepatocytes via PTEN/Akt pathway[J].Zhenyu Liu;;Jingjie Wang;;Chuanyong Guo;;Xiaoming Fan.Biomedicine&Pharmacotherapy,2015
[2]Hedgehog signaling pathway as key player in liver fibrosis:new insights and perspectives[J].Jing-Jing Yang;;Hui Tao;;Jun Li.Expert Opinion on Therapeutic Targets,2014(9)
[3]The molecular mechanism of species-specific recognition of lipopolysaccharides by the MD-2/TLR4 receptor complex[J].Alja Oblak;;Roman Jerala.Molecular Immunology,2014
[4]Epithelial‐mesenchymal transition‐related protein expression in biliary epithelial cells associated with hepatolithiasis[J].Rohyun Sung;;Sang Hwa Lee;;Meiying Ji;;Joung‐Ho Han;;Min Ho Kang;;Ji Hoon Kim;;Jae‐Woon Choi;;Young Chul Kim;;Seon Mee Park.J Gastroenterol Hepatol,2014(2)
[5]王芳.LPS通过激活TLR4诱导人肝内胆管上皮细胞上皮—间质转化[D].遵义医学院,2016.
