概述[1]
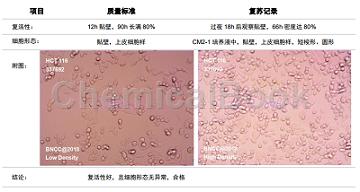
HCT 116的培养条件:37℃,5%CO2,CM2-1 培养液。CM2-1 培养液:90%RPMI-1640+10%FBS。RPMI-1640:1640 培养基,含谷氨酰胺。复苏步骤:①新制 100mm 平皿 1 个,含 12mL 上述培养液;②冻存管从液氮或-80℃中取出,37℃水浴 1~2min,待完全溶解后尽快移入安全柜复苏;③用无菌吸管吸取溶解液打入新制平皿中,顺时针摇匀;④放入(37℃,5%CO2)培养箱中,过夜换液,2-4 天长满。传代/冻存:将旧培养液吸除,PBS 清洗两遍后,加入 6mL(/100mm 皿)胰酶,在显微镜下观察,期间禁止摇晃培养皿,细胞刚有脱落时,则吸除大部分胰酶,留约 0.5mL,移至培养箱消化,约 2min 取出。传代用 12mL CM2-1 培养液终止消化,轻轻吹打均匀细胞,后可分 3~6 皿培养;冻存则用 6mL 冻存液(90%FBS+10%DMSO)终止消化,吹打均匀,分为 6 支冻存管,用程序降温盒于-80℃冻存。复苏质量记录:根据复苏要求,对以上细胞株进行复苏,记录结果如下:
相关研究[2-4]
于小鼠右前肢皮下注射HCT116细胞悬液100 μl,对照组注射100 μl PBS,造模第七天后给药,小檗碱低中高给药组分别腹腔单次注射10、20和40 mg/kg小檗碱和生理盐水溶液,阳性药物组小鼠腹腔注射20mg/kg氟尿嘧啶,对照组和模型组腹腔注射相同体积的生理盐水溶液。结果:小檗碱在体外对结肠癌细胞HCT116有抑制作用,半数抑制浓度IC50为0.24μmol/L。
小檗碱给药组(低、中、高剂量),阳性药物组、模型组和对照组于注射后的第1,7,14和21天时小鼠体重的比较,不同时间、不同组间小鼠体重有差别(P<0.05);6组的小鼠体重变化趋势有差别(P<0.05)。低、中、高剂量小檗碱组小鼠肿瘤体积低于模型组,呈现剂量依赖性改变(P<0.05)。低、中、高剂量小檗碱治疗组和阳性药物组的存活率均高于模型组(P<0.05),且小檗碱治疗组呈剂量依赖性改变。小檗碱治疗组和阳性药物组小鼠肿瘤组织重量均低于模型组(P<0.05)。小檗碱治疗组肿瘤组织中Caspase-9和Caspase-3基因表达高于模型组(P<0.05);肿瘤组织中Cytochrome C、Caspase-9和Caspase-3蛋白表达水平较模型组升高(P<0.05)。结论:小檗碱通过破坏线粒体释放CytochromeC,进而激活凋亡相关蛋白Caspase-9和Caspase-3的表达,诱导肿瘤组织细胞凋亡,发挥抗肿瘤活性。
设置100、50、25μg/mL莪术醇为高、中、低剂量组,不加药为空白对照组,顺铂5μmol/L为阳性药物组,药物干预24h,采用CCK8法检测不同浓度的莪术醇对结肠癌细胞HTC116的抑制作用,采用FDA染色实验观察结肠癌细胞各组生长状态,Western Blot(免疫印迹)实验检测凋亡蛋白BCL-2、BAX、Caspase9的表达变化。结果:莪术醇能有效抑制结肠癌细胞HCT116增殖。形态学上,空白组生长密集,阳性药物组细胞稀疏,高、中、低莪术醇组分别呈密集到稀疏趋势。在凋亡方面,莪术醇能上调凋亡蛋白BAX、Caspase9的表达,降低抗凋亡蛋白BCL-2的表达。结论:莪术醇能明显抑制HCT116细胞的分化增殖,其机制可能与上调凋亡蛋白BAX、Caspase9的表达,降低抗凋亡BCL-2的表达有关。
选用结直肠癌细胞HCT116,通过转染SIRT1质粒来过表达SIRT1,此为过表达组;通过siRNA来敲低SIRT1,此为敲低组;用MTT法、CCK-8法和克隆形成试验来测定HCT116细胞的增殖和活力情况;通过免疫印迹试验来检测NF-κB通路相关蛋白的表达情况。
结果过表达组中,p-P65、p-IKKalpha的表达量明显降低(P<0.05),而P65和IKKalpha的总体表达量没有明显差异(P>0.05),HCT116的生长速度、增殖速率以及细胞活力明显降低(P<0.05);敲低组中,p-P65、p-IKKalpha的表达量明显上升(P<0.05),而P65和IKKalpha的总体表达量没有明显差异(P>0.05),HCT116的生长速度、增殖速率以及细胞活力明显上升(P<0.05)。在过表达SIRT1的同时,用NF-κB的抑制剂Curcumin处理HCT116后,NF-κB通路相关蛋白的表达量以及HCT116的生长速度和增殖速率无明显变化(P>0.05)。结论 SIRT1通过抑制NF-κB的激活来降低结直肠癌细胞HCT116增殖和活力。
主要参考资料
[1] HCT 116/人结肠癌细胞说明书
[2] 李艳,伊航,蔡轶伦,林红艳,刘还秀.小檗碱抑制HCT116细胞在小鼠体内增殖的分子机制研究[J/OL].中国现代医学杂志:1-12[2019-04-05].http://kns.cnki.net/kcms/detail/43.1225.r.20190322.1311.016.html.
[3] 梁乔芳,廖小林,吴洪文.莪术醇对结肠癌细胞HCT116的影响及作用机制研究[J].亚太传统医药,2019,15(02):18-20.
[4] 王福海,张广超.SIRT1通过NF-κB通路调节结直肠癌细胞HCT116增殖和活力[J].解剖学研究,2019,41(01):20-24.
