背景[1-6]
人DNA损伤信号通路PCR芯片通路PCR芯片可用于研究参与DNA损伤信号通路的84个基因的表达。
相关的基因是那些与ATR/ATM信号网络和DNA损伤反应的可转录靶目标有关的基因。DNA损伤可以导致细胞周期阻滞,细胞凋亡,影响基因组稳定和修复。使通过实时定量PCR的方法,研究者即能够利用该芯片简单可靠地同时检测与DNA损伤信号通路相关的基因表达。DNA损伤响应涉及到损伤的感应、信号的传递、DNA修复等一系列通路和过程。
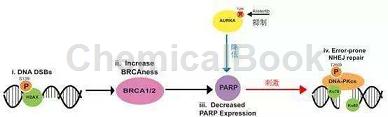
在这些过程中,有大量蛋白质以其不同的修饰状态参与其中。有些蛋白质的修饰参与信号的识别和传递;有些修饰改变酶的活性;而有些修饰则参与调节,有大量的研究者对参与DNA损伤相关蛋白的功能及修饰进行了研究。它们在DNA损伤响应分别发挥着不同的功能,其协同作用使细胞得以从细胞周期关卡中恢复,进入正常周期。有大量研究者对参与DNA损伤相关蛋白的功能及其修饰进行了研究。
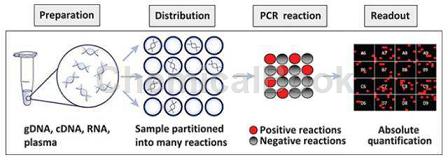
DNA损伤信号通路ChIP qPCR芯片分析参与DNA损伤信号通路的48个关键基因的组蛋白修饰状态或组蛋白密码。组蛋白修饰调节染色质结构和与相关基因的转录活性。每天暴露在环境因素(如活性氧物种,使甲基化剂、紫外线,和其他电离辐射),甚至正常的生理过程(如复制和重组)都会损DNA。DNA损伤是公认的细胞周期检查点,这样细胞可以逮捕细周期进程并修复有丝分裂前损伤,或进行细胞凋亡如果损害无法挽回。细胞必须修复DNA损伤,防止突变的积累和维持基因组的完整性和稳定性。
癌症进程中可能出现突变或组蛋白修饰导致这个信号通路失调。理解DNA损伤信号通路基因的组蛋白编码的变化可能会帮助阐明肿瘤形成的分子与表观遗传机制。这个芯片包含对细胞周期阻滞和细胞凋亡发挥重要作用的基因,以及参与DNA修复的基因。利用这个芯片通过染色质免疫沉淀和实时定量PCR,可以很简易、可靠地分析组蛋白的化学修饰模式与DNA损伤信号通路相关重要基因集的关联。
应用[7][8]
人DNA损伤信号通路PCR芯片可用于人DNA损伤信号通路的相关研究:
叶酸在MNNG致哈族DNMT1高表达细胞DNA损伤及相关信号通路中作用的研究中DNMT1高表达在DNA甲基化模式的转变和肿瘤的发生、发展中起促进作用。在前期已建立的哈萨克族食管上皮永生化细胞系的基础上,利用TALE技术构建DNMT1高表达的哈萨克族食管上皮细胞株,分析叶酸在MNNG致哈族食管上皮细胞DNMT1高表达细胞DNA损伤及相关信号通路调控机制中的作用,探讨叶酸对MNNG致细胞损伤过程中的干预作用,为食管癌预防和治疗提供理论依据。
方法:将哈族食管上皮细胞及哈族食管上皮DNMT1高表达细胞分别分为三组,使用MNNG进行染毒并分别施以低浓度叶酸、中等浓度叶酸及高浓度叶酸干预,使用倒置荧光显微镜观察各组细胞生长情况;应用单细胞凝胶电泳实验(彗星实验)检测各组细胞DNA损伤情况;应用RT-PCR方法检测各组细胞PI3K-AKT通路中PP2A、PTEN、AKT基因mRNA表达水平;应用Western blot法检测各组细胞PI3K-AKT通路中PP2A、PTEN、AKT的蛋白表达水平。
结果:(1)两种哈族食管上皮细胞形态损伤情况随染毒时间延长而加重,且在相同干预情况下,DNMT1高表达细胞较非高表达细胞受MNNG影响更为严重,但高浓度叶酸组细胞较同类型同时期低、中浓度叶酸组生长情况良好,细胞死亡率低,细胞排列整齐,形态正常,细胞镜下形态最接近于同类同时期对照组细胞;(2)两种食管上皮细胞DNA损伤情况随染毒时间延长而加重,且哈族食管上皮DNMT1高表达细胞较哈族食管上皮细胞DNA损伤情况更为严重,表现为尾长在染毒早期、中期、晚期时高于正常细胞组,差异有统计学意义。
参考文献
[1]Cancer statistics in China,2015[J].Wanqing Chen,Rongshou Zheng,Peter D.Baade,Siwei Zhang,Hongmei Zeng,Freddie Bray,Ahmedin Jemal,Xue Qin Yu,Jie He.CA:A Cancer Journal for Clinicians.2016(2)
[2]Nuclear Localization of DNAJB6 Is Associated With Survival of Patients With Esophageal Cancer and Reduces AKT Signaling and Proliferation of Cancer Cells[J].Valen Zhuoyou Yu,Victor Chun-Lam Wong,Wei Dai,Josephine Mun-Yee Ko,Alfred King-Yin Lam,Kwok Wah Chan,Rajeev S.Samant,Hong Lok Lung,Wai Ho Shuen,Simon Law,Yuen Piu Chan,Nikki Pui-Yue Lee,Daniel King Hung Tong,Tsz Ting Law,Victor Ho-Fun Lee,Maria Li Lung.Gastroenterology.2015(7)
[3]Selective inhibition of esophageal cancer cells by combination of HDAC inhibitors and Azacytidine[J].Theresa D Ahrens,Sylvia Timme,Jens Hoeppner,Jenny Ostendorp,Sina Hembach,Marie Follo,Ulrich T Hopt,Martin Werner,Hauke Busch,Melanie Boerries,Silke Lassmann.Epigenetics.2015(5)
[4]Obatoclax Induces G1/G0‐Phase Arrest via p38/p21waf1/Cip1 Signaling Pathway in Human Esophageal Cancer Cells[J].Desheng Zhong,Chunping Gu,Lili Shi,Tianrong Xun,Xiaojuan Li,Shuwen Liu,Le Yu.J.Cell.Biochem..2014(9)
[5]Folate Deficiency and Aberrant Expression of DNA Methyltransferase 1 were Associated with Cervical Cancerization[J].Wang Jin-tao,Ding Ling,Jiang Shi-Wen,Hao Junxia,Zhao Wei-min,Zhou Qin,Yang Zuo-kai,Zhang Li.Current Pharmaceutical Design.2014(11)
[6]Elevated serine protease HtrA1 inhibits cell proliferation,reduces invasion,and induces apoptosis in esophageal squamous cell carcinoma by blocking the nuclear factor-κB signaling pathway[J].Jin Xia,Feng Wang,Liuxing Wang,Qingxia Fan.Tumor Biology.2013(1)
[7]The roles of epidermal growth factor receptor(EGFR)inhibitors in the management of lung cancer[J].Ashwaq Al Olayan,Hamad Al Hussaini,Abdul Rahman Jazieh.Journal of Infection and Public Health.2012
[8]李旭峰.叶酸在MNNG致哈族DNMT1高表达细胞DNA损伤及相关信号通路中作用的研究[D].新疆医科大学,2017.
