背景[1-6]
人原代髓核细胞提取于人椎间盘髓核,原代冻存。每管含有细胞数>5×105 cells/ml,此细胞通过角蛋白及波形蛋白抗体免疫荧光染色验证,经测试不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌。
细胞可以达到15倍增。髓核是椎间类似凝胶样的物质。它的作用是在压缩负载的情况下全面地调节液压。髓核由软骨样的细胞,胶原纤维和蛋白多糖组成。髓核细胞存在于维管联结有限和通过无氧糖酵解产生能量的环境中。髓核细胞表达缺氧诱导因子-1以回应氧压和调节糖酵解。
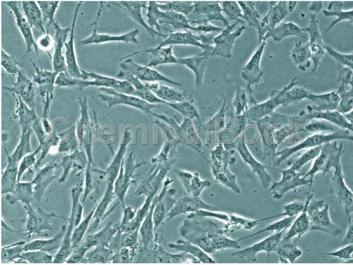
它们在胎儿和童年时候表达细胞角蛋白和波形蛋白:在细胞培养中分泌白细胞介素-1,-6,-10和粒细胞-巨噬细胞共刺激因子。髓核细胞体外培养为研究椎间盘退变,组织工程提供了细胞学及分子生物学机制。髓核,是乳白色半透明胶状体,富于弹性,为椎间盘结构的一部分,位于两软骨板与纤维环之间。由纵横交错的纤维网状结构即软骨细胞和蛋白多糖黏液样基质构成的弹性胶冻物质。
发育成熟的髓核是一个由软骨样细胞分散在细胞间质内,周围围绕着一个比较致密的胶原纤维网的含水球,位于椎间盘偏后位置,占推间盘横断面积的50%~60%;由于它的含水量很高,并和软骨终板紧密接触,是椎间盘接受经软骨终板主要营养途径渗透交换营养的主要部分。下腰痛是临床常见病,其病因主要是椎间盘退变所致。椎间盘退变的主要机制首先是椎间盘内髓核细胞逐渐衰老、凋亡,并导致细胞外基质的化学成分和结构改变。
细胞特性:
1)组织来源于实验动物的正常脊髓组织。
2)细胞鉴定:Ⅱ型胶原荧光染色为阳性。
3)经鉴定细胞纯度高于90%。
4)不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌。
5)细胞生长方式:长梭形细胞,不规则细胞,贴壁培养。
应用[7][8]
人原代髓核细胞可用于髓核细胞中p38亚型的差异性表达及其对椎间盘退变中巨噬细胞的极化作用研究:
椎间盘(Intervertebral disc,IVD)位于椎体之间,主要由髓核(Nucleus pulposus,NP)和纤维环(Annulus fibrosus,AF)构成,是人体脊柱结构的重要组成部分。其生理功能主要包括参与脊柱屈、伸、旋转等运动功能,维持椎间隙高度,以及承载负荷和分散应力等。目前已经证实,椎间盘退行性病变(Intervertebral disc degeneration,IDD)是引起下腰痛(Low back pain,LBP)及成人腰椎间盘突出症的主要原因之一。
近年来,随着椎间盘内炎性介质对椎间盘影响的研究快速发展,炎性反应(Inflammation)成为了椎间盘退变的重要研究方向。促炎因子(Pro-inflammatory cytokines)如TNF-α、IL-1、COX-2、IL-6、IL-8,IL-10以及基质金属蛋白酶类(Matrix metalloproteinases,MMPs)等均和腰椎间盘退变有关。而上述相关产物的基因表达都与丝裂原活化蛋白激酶(Mitogen activated protein kinase,MAPK)息息相关。丝裂原活化蛋白激酶是一种细胞外刺激经过一系列转导引起细胞核反应的重要信号通路。
P38 MAPK是丝裂原活化蛋白激酶家族中的重要成员,在细胞内担负着将细胞外各种有丝分裂和应急信号传递至细胞核以及调节相关基因表达从而介导细胞产生一系列反应的重要使命,是细胞内主要的信号转导系统。在椎间盘退变过程中,髓核细胞中p38 MAPK发挥了重要作用。椎间盘退变时,促炎因子(Pro-inflammatory cytokines)大量分泌聚集,此时,p38 MAPK介导髓核细胞多种分解代谢酶如ADAMTS-4、ADAMTS-5以及MMPs等表达增高。这些分解代谢酶类表达增强导致collagen-II(Col-II)、aggrecan等椎间盘细胞外基质成分大量降解。
此外,p38 MAPK信号通路还参与一系列椎间盘退变的细胞生理病理过程如凋亡、自噬、缺氧、血管翳生成等密切相关。P38 MAPK家族有四个成员:p38α(MAPK14)、p38β(MAPK11)、p38γ(MAPK12/ERK-6)以及p38δ(MAPK13/SAPK4)。这四种亚型的同源性达60%,但却由不同的上游激酶—丝裂原活化蛋白激酶激酶-3、-4、-6(MKK-3、MKK-4、MKK-6)—选择性磷酸化。值得注意的是,尽管p38 MAPK在椎间盘退变过程中发挥了重要作用,然而有关p38 MAPK各亚型在参与椎间盘退变中的具体作用机制尚不清楚。
参考文献
[1]Modulating macrophage polarization with divalent cations in nanostructured titanium implant surfaces[J].Chung-Ho Lee,Youn-Jeong Kim,Je-Hee Jang,Jin-Woo Park.Nanotechnology.2016(8)
[2]Aging and age related stresses:a senescence mechanism of intervertebral disc degeneration[J].F.Wang,F.Cai,R.Shi,X.-H.Wang,X.-T.Wu.Osteoarthritis and Cartilage.2015
[3]Macrophage repolarization with targeted alginate nanoparticles containing IL-10 plasmid DNA for the treatment of experimental arthritis[J].Shardool Jain,Thanh-Huyen Tran,Mansoor Amiji.Biomaterials.2015
[4]Potential roles of cytokines and chemokines in human intervertebral disc degeneration:interleukin-1 is a master regulator of catabolic processes[J].K.L.E.Phillips,K.Cullen,N.Chiverton,A.L.R.Michael,A.A.Cole,L.M.Breakwell,G.Haddock,R.A.D.Bunning,A.K.Cross,C.L.Le Maitre.Osteoarthritis and Cartilage.2015(7)
[5]Pro-inflammatory responses of RAW264.7 macrophages when treated with ultralow concentrations of silver,titanium dioxide,and zinc oxide nanoparticles[J].Marcella Giovanni,Junqi Yue,Lifeng Zhang,Jianping Xie,Choon Nam Ong,David Tai Leong.Journal of Hazardous Materials.2015
[6]Understanding the Mysterious M2 Macrophage through Activation Markers and Effector Mechanisms[J].Tamás R?szer,Yona Keisari.Mediators of Inflammation.2015
[7]The catabolic effect of TNFαon bovine nucleus pulposus intervertebral disc cells and the restraining role of glucosamine sulfate in the TNFα‐mediated up‐regulation of MMP‐3[J].Eleni Mavrogonatou,Maria T.Angelopoulou,Dimitris Kletsas.J.Orthop.Res..2014(12)
[8]高阳.髓核细胞中p38亚型的差异性表达及其对椎间盘退变中巨噬细胞的极化作用研究[D].第二军医大学,2017.
