背景及概述[1]
索玛鲁肽(semaglutide)是由丹麦诺和诺德公司(NovoNordisk)开发的新一代GLP-1(胰高血糖素样肽-1)类似物,分子式为C187H291N45O59,分子量为4113.58,CAS号为910463-68-2。索玛鲁肽是基于利拉鲁肽基本结构而开发的长效剂型,其治疗2型糖尿病的效果更好。
诺和诺德已完成索玛鲁肽注射剂的6个PhaseIIIa研究,并已于2016年12月5日向美国食品药品监督管理局(FDA)递交了索玛鲁肽每周一次注射剂的新药注册申请,也向欧洲药品管理局(EMA)提交了一份市场营销授权申请(MAA)。另一方面,索玛鲁肽每日一次的口服制剂目前处于临床三期。
市场预测[1]
索玛鲁肽皮下注射剂将于2017年12月31日上市,EvaluatePharma公司对该产品的市场销售进行了预测,索玛鲁肽注射剂于2022年在全球销售额达到22.04亿美元。
临床研究[1]
1)临床二期研究显示,索玛鲁肽口服制剂在降糖及减肥上有效2015年2月20日,诺和诺德宣布了索玛鲁肽(OG217SC)的PhaseⅡ试验结果。通过600名2型糖尿病患者为期26周的试验,口服索玛鲁肽2.5-40mg的5个不同剂量,26周后,相比平均7.9%的HbA1c基线,HbA1c降低了0.7%-1.9%。皮下注射1mg的索玛鲁肽显著优于安慰剂组,HbA1c降低更多(1.9%vs0.3%)。确定试验终点,所有口服剂量的索玛鲁肽组都优于安慰剂组。
在降低体重方面,相比92kg的平均基线体重,皮下注射索玛鲁肽治疗组降低了体重5.6kg,这与剂量口服索玛鲁肽的效果相当。而安慰剂在减轻体重上只有1kg。索玛鲁肽有很好的安全性和耐受性,常见不良反应发生在胃肠道,主要是恶心、呕吐,症状随时间消失。胃肠道不良反应呈剂量依懒性,口服剂量的不良反应率高于皮下注射组。不同治疗组间的其它不良反应没有明显差异。
2)索玛鲁肽口服制剂进入三期临床2015年8月26日,诺和诺德宣布了索玛鲁肽口服制剂的PhaseⅢa计划,包括6个安全有效性试验和一个心血管安全性评价试验,试验人群约有8000名2型糖尿患者。
而发起的个试验是与100mg西格列汀的对比试验,将调查每日口服一次3mg剂量、7mg剂量、14mg剂量索玛鲁肽的安全性和有效性。其它试验如安全有效性评价试验,与恩格列净的对比试验,单一治疗试验,与利拉鲁肽对比试验,对肾功能不全患者的试验,心血管方面的试验也于2016年发起,最早的试验结果将于2018年公布。
索玛鲁肽口服制剂预计于2019年12月31日上市,EvaluatePharma公司对诺和诺德的口服索玛鲁肽在全球的销售进行预测,2022年销售为7.6亿美元。
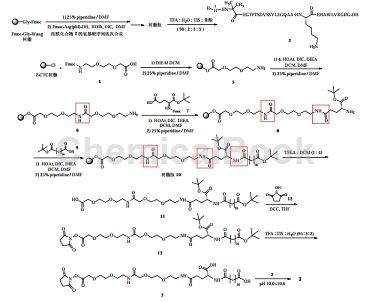
制备[2]
采用固液相合成法制备索玛鲁肽。固相合成法制备直链肽Aib8,Arg34GLP-1(7-37)以及脂肪侧链酰化剂,在碱性条件下用合成的脂肪链酰化剂对直链肽Lys26进行修饰,得到索玛鲁肽,并通过时间分辨荧光共振能量转移免疫测定法对自制的样品进行生物活性测定。结果显示两个批次的样品生物活性相当,其EC50是利拉鲁肽的1/2。该工艺原料价廉易得、收率高,易于工业化生产。
主要参考资料
[1] 索玛鲁肽临床研究综述
[2] 索玛鲁肽的制备
