
第1阶段:样品制备
首先,我们收获细胞或组织并制备单细胞悬浮液。然后,我们将根据所使用的细胞数量和体积,将单细胞悬浮液转移到96孔板、试管或聚苯乙烯圆底管中。
所需材料:
-细胞悬液
-聚苯乙烯圆底12×75 mm2法尔肯试管/96孔板(或与您的离心机兼容的任何 容器)
-悬浮液/洗涤缓冲液(PBS、5-10%胎儿细胞血清(FCS))
-可选–红细胞裂解缓冲液(例如,R377982)
步骤
所需时间约20分钟
1 根据指导收获和洗涤细胞。
1.1 对于血液样本,我们建议将样本与红细胞裂解缓冲液(例如R377982)一起 孵育。
提示1:红细胞裂解缓冲液会裂解红细胞,这可能会干扰白细胞(有核细 胞)的分析。
提示2:通过避免气泡、剧烈涡旋、缓冲液更换期间吸出整个溶液以及 过度离心来 防止细胞损伤。
2 确定细胞总数并检查细胞活力。
2.1 一般来说,存活率应为90-95%。
3 离心并在冰冷的悬浮缓冲液中重悬细胞样品。
3.1 在4°C下以约200g离心5分钟,
3.2 推荐的悬浮细胞浓度:0.5–1×106个细胞/mL。
提示:旋转时间和速度可能需要优化。一般来说,应充分离心细胞以便 去除上清液,但为了不会造成细胞损失,离心力不要太强,以免细胞难 以重悬。
警告: 较高细胞浓度可能会堵塞流式细胞仪系统并影响分辨率。
4 继续用活性染料染色。
第2阶段:使用活性染料进行活细胞/死细胞染色
由于死细胞容易与抗体发生非特异性结合,因此我们必须将这些细胞排除在分析之外。使用活性染料使我们能够区分活细胞和死细胞,并在数据采集和分析过程中排除死细胞。
DNA结合染料(例如7-AAD、DAPI和TOPRO3)通常用作活细胞/死细胞染色的活性染料,因为它们无法穿透活细胞的细胞膜。死细胞中受损的细胞膜使这些染料能够接触DNA,与DNA结合并发出荧光。
然而,这些染料不能用于固定细胞的活/死染色,否则所有细胞的细胞膜都会受到损害。在这种情况下,我们必须使用胺反应性可固定细胞活力染料。
所需材料:
-活性染料
-不可固色染料的示例:7-AAD、DRAQ-5(D266292)、DRAQ-7(D266297), 或 DAPI (D598342)
-可固色染料
-悬浮液/洗涤缓冲液(例如:PBS、5-10% 胎儿细胞血清(FCS))
步骤
1 用活性染料对细胞进行染色。
1.1 根据制造商的说明,在4°C的黑暗中用染料孵育细胞。
警告:将荧光团保存在黑暗中以避免光漂白。
提示: 选择发射光谱不与免疫染色所用荧光团重叠的染料。
2 用洗涤缓冲液洗涤细胞两次。
2.1 将细胞向下旋转(200g,5分钟,4°C),去除上清液,并在每次洗涤 后重新悬浮沉淀。
提示:洗涤步骤数、旋转时间和速度可能需要优化。当使用过量的 洗涤缓冲液并在离心后去除尽可能多的液体时,一次洗涤步骤可能 就足够了。
3 当检测细胞外靶标时继续封闭,或者对细胞内靶标进行固定和透化。
第3阶段:固定和透化(仅适用于细胞内染色)
当对细胞内靶标进行染色时,我们必须进行额外的固定和透化步骤。需要固定保留细胞内蛋白质的结构。透化作用会破坏细胞膜,使抗体进入细胞并对细胞内靶标进行染色。
当对细胞外靶标进行染色时,我们将立即进行封闭步骤。当一起分析细胞内和细胞外靶标时,我们需要在固定和透化之前进行细胞表面染色(参见第5阶段)。
选择合适的细胞内染色固定和透化方法的有用提示:
-靠近质膜的抗原和可溶性细胞质抗原需要轻度细胞透化,无需固定。
-细胞骨架、病毒和一些酶抗原当用高浓度的丙酮、酒精或甲醛固定时,通常会产生最佳结果。
-细胞质细胞器和颗粒中的抗原是否需要固定和透化方法,具体取决于抗原。
-表位需要保持可接近性。
所需材料:
-细胞悬液
-悬浮缓冲液(PBS、5-10% FCS)
-固定剂(例如1-4%多聚甲醛、90%甲醇或丙酮)
-透化溶液(例如Triton X-100、NP-40或皂苷)
-或者您可以使用流式细胞术固定和透化试剂盒,适用于大多数样本类型。
步骤
所需时间约1小时15分钟
1 用您选择的固定剂固定细胞。
1.1 将细胞离心成沉淀(200g,5分钟,4°C),弃去上清液,并将沉淀重悬 于固定剂中。
1.2 如下所示用固定剂孵育细胞。
提示:固定需要针对不同抗原进行优化。 有些表位对甲醇非常敏感,因 此如果检测出现任何问题,请尝试使用丙酮。
2 用悬浮缓冲液洗涤细胞两次。
2.1 将细胞离心(200g,5分钟,4°C),弃去上清液,并重悬于洗涤缓冲液中。
提示:洗涤步骤数、旋转时间和速度可以进行优化。当使用过量的洗涤 缓冲液并在离心后去除尽可能多的液体时,一次洗涤步骤可能就足够了。
3 通过用合适的去污剂孵育细胞来透化细胞。
3.1 将细胞离心成沉淀(200g,5分钟,4°C),弃去上清液,并重新悬浮在洗涤剂溶液中。
3.2 将细胞在去污剂中室温孵育10-15分钟。
3.3 注意:如果使用丙酮作为固定剂,则不需要此步骤,因为丙酮也可以透化细胞。
提示1:最佳去垢剂的选择取决于蛋白质及其定位。Triton或NP-40等强 效去污剂会部分溶解核膜,因此适合核抗原染色。相比之下,温和的去 污剂,如Tween 20或皂苷,使抗体能够穿过孔而不溶解质膜,这使得它 们适合细胞质或质膜细胞质面的抗原和可溶性核抗原。
提示2:应根据您的样品优化去污剂的浓度。提示3:透化会影响细胞在 流式细胞仪上的光散射谱;在检测和数据分析(第6阶段)期间对细胞群 进行门控时,请记住这一点。
4 用悬浮缓冲液洗涤细胞两次。
4.1 将细胞离心(200g,5分钟,4°C),弃去上清液,并重新悬浮在洗涤缓 冲液中。
提示:洗涤步骤数、旋转时间和速度可能需要优化。当使用过量的洗涤 缓冲液并在离心后去除尽可能多的液体时,一次洗涤步骤可能就足够。
5 进行后续阻断步骤。
第4阶段:阻断
阻断蛋白质和Fc结构域对于防止抗体与细胞非特异性结合至关重要。
所需材料:
材料的选择取决于被分析的细胞类型以及所使用的二抗(如果适用)
FcR封闭缓冲液(例如,2-10%山羊血清、人IgG或小鼠抗CD16/CD32)
悬浮缓冲液(PBS、5-10% FCS)
步骤
所需时间约45分钟
1 用封闭缓冲液封闭Fc受体。
1.1 将细胞离心成沉淀(200g,5分钟,4°C),弃去上清液,并重悬于封闭缓 冲液中。
1.2 将细胞与缓冲液在黑暗中于4°C孵育30-60分钟。
2 用洗涤缓冲液洗涤细胞两次。
2.1 将细胞向下旋转(200g,5分钟,4°C),去除上清液,并在每次洗涤后重 新悬浮沉淀。
提示:洗涤步骤数、旋转时间和速度可能需要优化。当使用过量的洗涤 缓冲液并在离心后去除尽可能多的液体时,一次洗涤步骤可能就足够 了。
3 继续进行抗体孵育。
第5阶段:抗体孵化
我们现在准备用荧光团偶联的抗体对细胞进行染色,以便在流式细胞仪中进行间接或直接检测。
以下程序也可以重复并适用于多色流式细胞术,其中针对不同靶标使用多组荧光团缀合抗体。当使用多组抗体时,我们应该尽量减少荧光团发射光谱的重叠。
直接抗体标记
所需材料:
-缀合一抗
-样品(0.5-1×106细胞/mL的细胞悬浮液)
-悬浮缓冲液(PBS、5-10% FCS)
步骤
时间约40分钟
1 在悬浮缓冲液中稀释结合的一抗。
1.1 数据表上通常会提供每种抗体的建议稀释度。
提示: 通过连续稀释来滴定抗体将有助于找到最适合您的实验的抗体浓度。
2 在预稀释的一抗中孵育细胞。
2.1 将细胞离心(200 g,5分钟,4°C),弃去上清液,并将细胞重悬于一抗溶 液中。
2.2 4°C避光孵育20-30分钟。固定细胞可以在室温或4°C下孵育。
提示:此步骤可能需要优化。
警告:将荧光团保存在黑暗中以避免光漂白。
3 用悬浮缓冲液洗涤细胞两次。
3.1 将细胞离心(200g,5分钟,4°C),去除上清液,并在每次洗涤后重新悬 浮。
3.2 提示: 洗涤步骤数、旋转时间和速度可能需要优化。当使用过量的洗涤 缓冲液并在离心后去除尽可能多的液体时,一次洗涤步骤可能就足够。
4 尽快进行流式细胞仪检测。
4.1 如果抗体染色后(1小时内)未立即在流式细胞仪中分析细胞且未提前固 定,则可在此步骤固定染色细胞(1-4% PFA,4°C ,20分钟)。固定有助于 将细胞保存数天,稳定光散射并灭活大多数生物危害剂。控件需要使用 相同的程序进行固定。 请注意,固定会杀死细胞,并且与不可固定的细 胞活力染料不兼容(如果之前使用过这些染料)。
提示:孵育后立即获得最佳结果。
警告: 如果您打算实时研究细胞,请勿修复细胞。
4.2 固定后洗涤细胞3次,并将细胞悬液储存在悬浮缓冲液中。
4.3 请遵循使用说明。
提示: 将细胞保存在黑暗的冰上或4°C的冰箱中,直到您安排的分析时间。
间接抗体标记
间接标记需要两个孵育步骤,首先使用一抗,然后使用兼容的二抗。二抗(而非一抗)结合有荧光染料(FITC、PE、Cy5®等)。
所需材料:
-一抗
-偶联二抗
-样品(0.5 – 1×106 细胞/mL 的细胞悬浮液)
-悬浮液/洗涤缓冲液(PBS,5-10% FCS)

步骤
时间约1小时15分钟
1 在悬浮缓冲液中稀释一抗和二抗。
1.1 抗体数据表上通常会提供每种应用的建议稀释度。
提示:通过连续稀释来滴定抗体将有助于找到最适合您的实验的抗体浓度。
2 在预稀释的一抗中孵育细胞。
2.1 将细胞离心(200g,5分钟,4°C),弃去上清液,并重悬于一抗溶液中。
2.2 4°C避光孵育20-30分钟。固定细胞可以在室温或4°C下孵育。
提示:可能需要优化孵育时间。
3 用悬浮缓冲液洗涤细胞两次。
3.1 每次洗涤后将细胞向下旋转(200g,5分钟,4°C),除去上清液并重新悬 浮沉淀。
3.2 提示:洗涤步骤数、旋转时间和速度可能需要优化。当使用过量的洗涤 缓冲液并在离心后去除尽可能多的液体时,一次洗涤步骤可能就足够了。
4 在预稀释的二抗中孵育细胞。
4.1 将细胞离心(200g,5分钟,4°C),弃去上清液,并将沉淀重悬于 二抗溶 液中。
4.2 在黑暗中孵育20-30分钟 将荧光团保持在黑暗中以避免光漂白非常重要。
5 用洗涤缓冲液洗涤细胞两次。
5.1 将细胞离心成沉淀(500g,5分钟,4°C),弃去上清液,并重悬于洗涤缓 冲液中。
5.2 提示:洗涤步骤数、旋转时间和速度可能需要优化。当使用过量的洗涤 缓冲液并在离心后去除尽可能多的液体时,一次洗涤步骤可能就足够。
6 尽快进行流式细胞仪检测。
6.1 如果抗体染色后(1小时内)未立即在流式细胞仪中分析细胞且未提前固 定,则可在此步骤固定染色细胞(1-4% PFA,4°C, 20分钟)。固定有助于 将细胞保存数天,稳定光散射并灭活大多数生物危害剂。控件需要使用 相同的程序进行固定。 请注意,固定会杀死细胞,并且与不可固定的细 胞活力染料(如果之前使用过)不兼容。
提示:孵化后立即获得最佳结果。
警告:如果您打算实时研究细胞,请勿修复细胞。
6.2 固定后洗涤细胞3次,并将细胞悬液储存在悬浮缓冲液中。
6.3 按照使用说明进行数据采集。
提示: 将细胞保存在黑暗的冰上或4°C的冰箱中,直到您安排的分析时间。
第6阶段:检测和数据分析
抗体孵育后,我们可以在流式细胞仪中运行我们的实验。该程序很大程度上取决于所使用的设备,因此请务必首先咨询制造商。
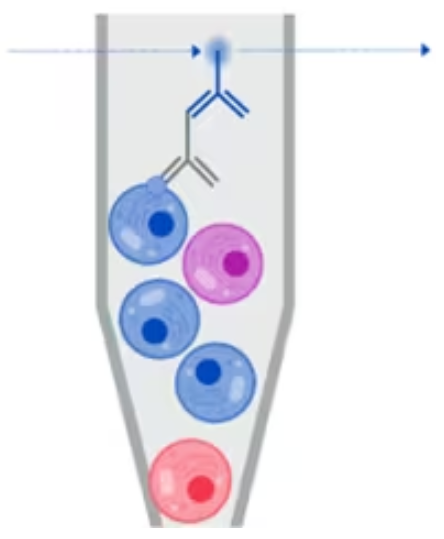
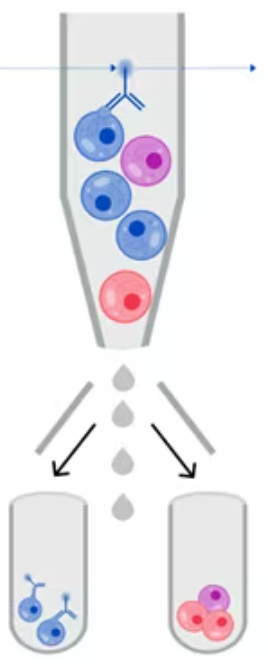
当表面染色的细胞是活细胞且未固定或透化时,可以使用荧光激活细胞分选 (FACS) 将其分离。利用 FACS,可以根据活细胞的特性将其分为不同的群体。然后我们可以对分离的细胞进行下游分析。
如需了解更多信息,请访问我们的官网,旨在帮助您从细胞中获得最佳数据。
参考文献
Nguyen R, Perfetto S, Mahnke YD, Chattopadhyay P & Roederer M. Quantifying spillover spreading for comparing instrument performance and aiding in multicolor panel design. Cytometry A 2013;83(3):306-315.
Kalina, T., Lundsten, K. and Engel, P. (2020), Relevance of Antibody Validation for Flow Cytometry. Cytometry A, 97: 126-136.