为推进仿制药一致性评价工作,总局自2017年3月17日,分批次陆续公布仿制药参比制剂目录,供企业进行仿制药/一致性评价研发工作选择参比制剂。为规范仿制药审评和一致性评价工作,优化工作程序,强化服务指导,保证公平、公正、公开,药审中心开始组织遴选参比制剂,并于2019年3月28日开始公示仿制药参比制剂目录征求意见稿。截止目前,参比制剂共分为正式通稿、征求意见稿、增补_征求意见稿、未通过审议品种目录、无推荐参比、参比制剂调出品种目录六类。下面,我们来看看未通过审议品种目录。
未通过审议品种目录最开始出现在CDE发布的《化学仿制药参比制剂目录(第二十五批)》(征求意见稿)中,截止目前已公布321个,近300个品规。总的来说,每一批公布的数量没有规律,第43批数量最多。
征求意见稿历史批次未通过审议参比公布情况:

未通过审议原因:
参比制剂遴选未通过审议的主要原因如下:
安全、有效性问题:
a.拟申请参比制剂缺乏完整充分的安全有效性数据,审议未通过。如:日本共和薬品工業株式会社的盐酸甲氯芬酯片、法国Fresenius Kabi Deutschland GmbH 的小儿苹果酸电解质注射液Ⅱ、美国American Regent Inc的盐酸罂粟碱注射液。
b.本品存在安全性风险,审议未通过。如未进口原研盐酸芬特明托吡酯缓释胶囊存在心率升高、药物滥用、自杀行为等诸多安全性风险,注射用氢化可的松琥珀酸钠规格超过国内说明书批准的单次剂量,存在安全性风险。
不具参比制剂地位:
c.拟申请参比制剂为日本/美国上市的仿制药,不具有参比制剂地位,审议未通过。如:日本救急药品工业株式会社的盐酸多奈哌齐口溶膜、美国BPI Labs, LLC的盐酸肾上腺素注射液/肾上腺素注射液。
d.为确保参比制剂的质量,建议参比制剂首选欧盟、美国以及日本等监管体系较为完善的机构批准上市的原研药品,审议未通过。如加拿大上市药品骨化三醇软胶囊剂,其原研厂家是Validus Pharmaceuticals LLC、Roche Pharma (Schweiz) Ltd.。
规格、剂型问题:
e.本品为改规格品种,原研无此规格。如胞磷胆碱钠注射液(2ml:0.2g、5ml:0.5g、5ml:1g),该品种原研规格为4ml:1g(以胞磷胆碱计)、4ml:500mg(以胞磷胆碱计)。
拟申请参比制剂规格与我国已获批规格不同。其日剂量范围适宜我国患者使用,无剂量调整需要,审议未通过。如大塚製薬株式会社的阿立哌唑口崩片(3mg、6mg、12mg、24mg),我国阿立哌唑口崩片已获批规格分别为5mg、10mg、15mg、20mg。
f.本品为改剂型品种,原研无此剂型。如泮托拉唑钠肠溶胶囊,原研剂型有肠溶片、注射剂、干混悬剂。
工艺问题:
g.拟申请参比制剂采用除菌过滤工艺,国内上市品种可耐受终端灭菌,审议未通过。如溴甲纳曲酮注射液。
企业对公示或已发布的参比制剂有异议的,可向药审中心提出异议和建议。药审中心将对企业提交论证资料进行审核,并进行分类处理。
未通过审议品种目录及其原因请查看药智数据-仿制药参比制剂目录数据库。
未通过审议参比剂型分布:
未通过审议参比目录中注射剂有151个,占比达47%,位居;其次是片剂21%,滴眼剂占比为5%,具体剂型占比情况见下图:
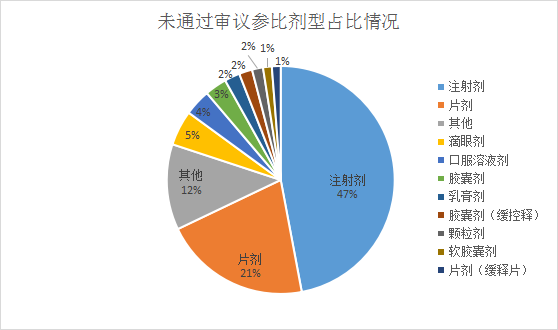
图一:未通过审议参比剂型占比情况
数据来源:药智数据、药智咨询整理
未通过审议参比证商情况:
在未通过审议参比目录中有23个未公布持证商。除此之外,大塚製薬株式会社最多有8个;其次是沢井製薬株式会社有7个,GE Healthcare AS有5个。前十中有六家企业为日本企业,日本开发的较多独特剂型、规格在我国未得到认可,参比制剂主要还是来源于欧美国家。未通过审议目录持证商Top10见下图:
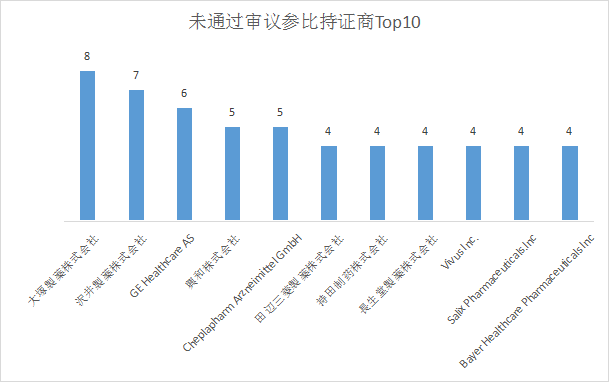
图二:未通过审议参比持证商Top10
数据来源:药智数据、药智咨询整理
备注:由于存在并列情况,所以上述排行中只列出了前10的持证商。
大塚製薬株式会社未通过审议参比品种为阿立哌唑口崩片(3mg、6mg、12mg、24mg),未通过审议原因为:经一致性评价专家委员会审议,拟申请参比制剂规格与我国已获批规格不同。其5-30mg/日剂量范围适宜我国患者使用,无剂量调整需要,审议未通过;企业对该结果提出异议申请后,再次经一致性评价专家委员会审议,专家维持原结论,二次审议未通过。我国阿立哌唑口崩片已获批规格分别为5mg、10mg、15mg、20mg。
沢井製薬株式会社有7个品规未通过审议,其中阿加曲班注射液(20ml: 10mg)未通过审议原因为:为改规格品种,已发布原研进口为参比制剂,原研无此规格。尼扎替丁胶囊未通过审议原因为:拟申请参比制剂为日本上市的仿制药,不具有参比制剂地位,且存在亚硝胺杂质风险。除此之外的5个品规未通过审议原因均为:拟申请参比制剂为日本上市的仿制药,不具有参比制剂地位,且临床上已有效果更好、不良反应更小的药品替代,审议未通过。
GE Healthcare AS未通过审议参比品种为钆双胺注射液,未通过审议原因为:经一致性评价专家委员会审议,本品存在安全性风险,审议未通过;企业对该结果提出异议申请后,再次经一致性评价专家委员会审议,专家维持原结论,二次审议未通过。
未通过审议参比来源情况:
未通过审议参比来源最多的是未进口原研药品,占比达40%;其次是美国、日本等国家上市药品,占比26%,具体来源情况见下图:
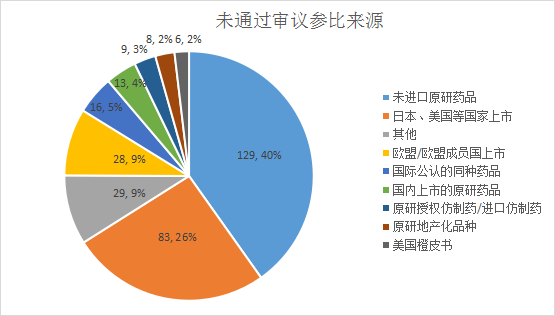
图三:未通过审议参比来源
数据来源:药智数据、药智咨询整理