免疫印迹(Western blot,WB)是一种常用于检测样品中特定蛋白质的技术,其基本原理和标准实践操作流程如下:
一、基本原理
Western blot 的核心目的是从复杂蛋白混合物中识别并半定量某一特定蛋白。其原理可分为三步:
1.按分子量分离蛋白:利用SDS-PAGE凝胶电泳,将变性蛋白按大小分开,分子量小的迁移快,大的慢。
2.蛋白“搬家”到膜上:通过电转将凝胶中的蛋白转移到固相膜(如PVDF或NC膜)上,以便后续抗体识别。
3.特异性识别目标蛋白:使用一抗特异性结合目标蛋白,再用带标记的二抗(如HRP)结合一抗,通过化学发光等方法显色,实现检测。
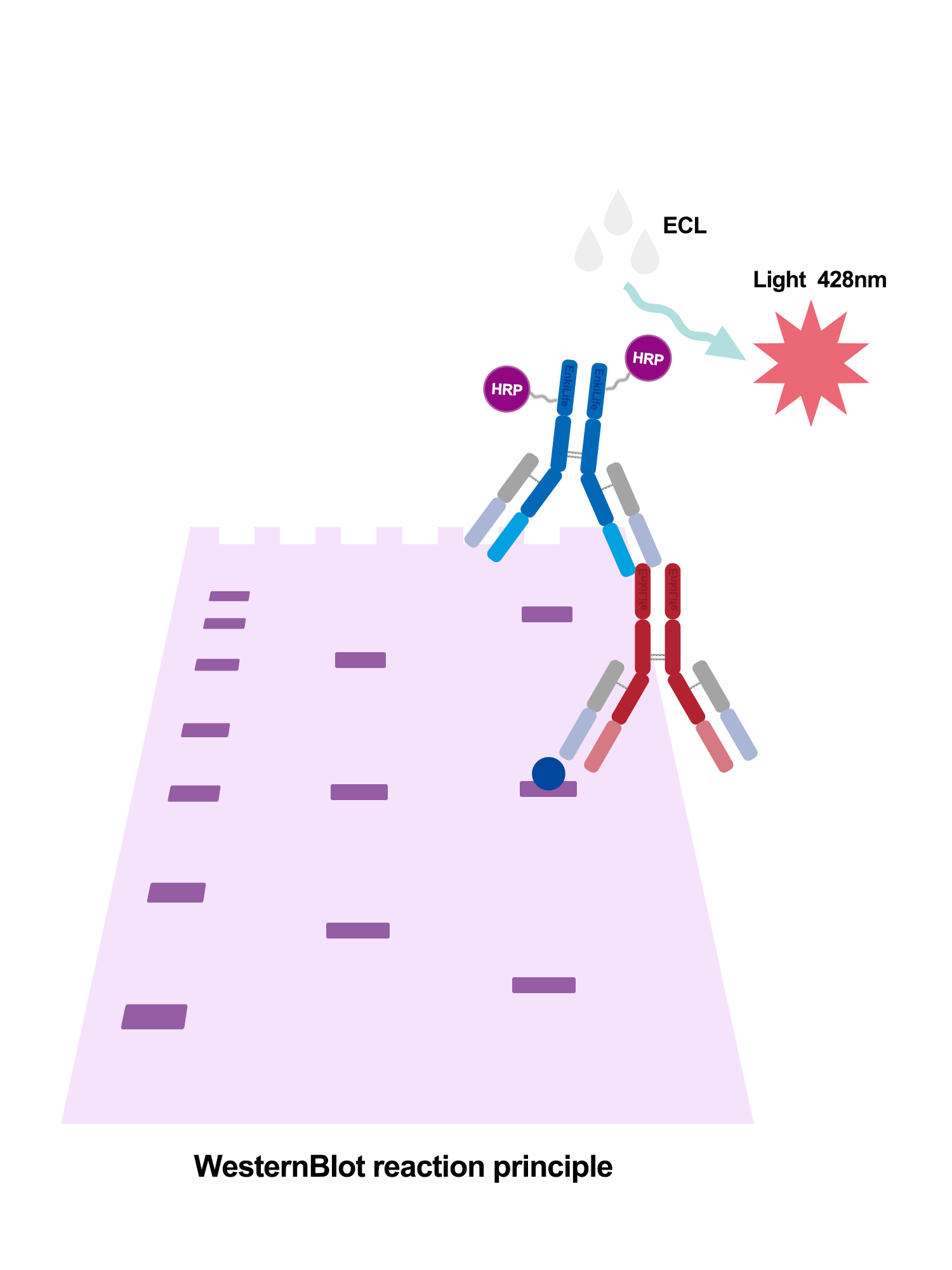
二、实践操作流程
传统WB实验流程较长,通常分为以下七大步骤:
1. 总蛋白提取
RIPA 裂解液(强)(Cat#: RC0160)在临用前需加入蛋白酶抑制剂,根据不同样本添加不同蛋白酶抑制剂防止蛋白降解。
A) 对于组织样品:
l 组织块用预冷 PBS洗涤,去除血污,剪成细小碎块置于匀浆器中。
l 加入 10 倍组织体积 RIPA 裂解液(强)低温匀浆
注:RIPA 裂解液(强)的使用量可按照约每 50 mg 组织与 500 μL 裂解液的比例添加。如组织蛋白含量较低,可降低裂解液的用量,以提高粗提溶液中的蛋白浓度。
l 将匀浆液转移至 1.5 mL 离心管中,振荡。冰浴 30 min,期间每 10 min 用移液器反复吹打,确保组织细胞完全裂解;
l 12000 g 离心 5 min,收集上清,即为总蛋白溶液。
B) 对于贴壁细胞样品:
l 用 PBS 清洗细胞 2-3 次,最后一次彻底吸干残留液。
l 按照 6 孔板每孔细胞 250 μL 裂解液的比例吸取 RIPA 裂解液(强)于细胞培养板、瓶内,反复晃动培养板、瓶,使裂解液与细胞充分接触 3-5 min。
l 用细胞刮刀将细胞刮下,收集到离心管中。
l 冰上裂解 30 min。
l 12000 g 离心 5 min,收集上清,即为总蛋白溶液。
C) 对于悬浮细胞样品:
l 离心收集细胞。
l 按照 6 孔板每孔细胞 250 μL 裂解液的比例将细胞液与 RIPA 裂解液(强)混合,振荡。
l 冰浴 30 min,期间每 10 min 用移液器反复吹打数次,确保细胞完全裂解。
l 12000 g 离心 5 min,收集上清,即为总蛋白溶液。
D) 对于细菌或真菌样本:
l 取 1 mL 菌悬液,离心去上清,PBS 洗涤一次,充分去除液体。涡旋使菌体尽量分散。
l 加入 100-200 μL RIPA 裂解液(强),轻轻涡旋使菌体与裂解液充分混匀。
l 冰浴 10 min,期间每 2 min 用移液器反复吹打数次,确保菌体完全裂解。
l 12000 g 离心 5 min,收集上清,即为总蛋白溶液。
2. 总蛋白浓度测定
可按照BCA法测定蛋白浓度(Cat#: BC00006)。
A) 实验前准备
l 蛋白标准品的准备:取 0.8ml 蛋白标准配制液加入到一管蛋白标准品(20mg BSA)中,充分溶解后配制成25mg/ml 的蛋白标准溶液。取适量 25mg/ml 蛋白标准品,稀释至终浓度为1mg/ml,标准品的稀释溶液一般与待测样品的溶液相同。也可用 0.9%NaCl 或PBS稀释标准品。蛋白标准溶液及稀释后蛋白标准品溶液均可以-20ºC 长期保存。
l BCA 工作液配制:根据样品数量,按 50 体积 BCA 试剂 A 加 1 体积 BCA 试剂B(50:1)配制适量BCA工作液,充分混匀。例如 5ml BCA 试剂 A 加 100µl BCA 试剂B,混匀,配制成5.1ml BCA工作液。BCA 工作液室温 24 小时内稳定。
B) 操作流程
l 将 1mg/ml 标准品溶液,通过对半稀释为 0.5mg/ml,0.25mg/ml,0.125mg/ml,0.0625mg/ml,0mg/ml(空白孔),并各取 20µl 加入 96 孔板的标准品孔中。
l 加适当体积样品到 96 孔板的样品孔中。如果样品不足 20µl,需加标准品稀释液补足到20µl。本试剂盒测定的蛋白浓度范围为 0.02-1.5mg/ml,如样品蛋白浓度过大,需要进行稀释。
l 各孔加入 200µl BCA 工作液,37ºC 放置 30 分钟。
l 用酶标仪测定 A562,或 540-595nm 之间的其他波长的吸光度。结果计算根据标准曲线和使用的样品体积计算出样品的蛋白浓度。
3.制样
将上步取得的蛋白上清液与5×上样缓冲液(Cat#: RA10055)按4:1的比例混合,涡旋混匀;室温溶解本品后,按照样本体积的1/4添加相应体积的本品;95℃水浴或金属浴加热10min,使蛋白充分变性;待样本冷却至室温,即可直接上样或-20ºC保存备用。
4.电泳(使用预制胶板请忽略此步骤)
电泳时需要设计好加样顺序,做好实验记录,按照预定顺序加样。具体操作流程如下:
A)灌胶与上样
l 准备玻璃板:确保两块玻璃板下缘水平且均无豁口,安装时内长外短,垂直卡在架子上准备灌胶(操作前先往玻璃板间灌水,检查是否漏液)。
l 加分离胶:按实验需求选择合适的分离胶和浓度配置,摇匀即可灌胶。配制凝胶时要充分混匀,此外应保证试剂的新鲜,特别是过硫酸铵。
l 加浓缩胶:当水和胶之间有一条折射线时,说明胶已凝固。再等几分钟即可倒去胶上层水并用吸水纸将水吸干。按说明书配制浓缩胶,加入 TEMED 后立即摇匀即可灌胶。梳子插入浓缩胶时,插梳子时要使梳子保持水平,确保没有气泡。凝固后,放电泳液中4ºC保存备用。
l 上样:胶凝固后连同玻璃板一起安装到电泳槽上,加入电泳缓冲液后按照预定顺序加样。一般在第一个孔或头尾孔内加入预染 marker,其余孔加入样品。
B)跑胶
电泳时上层胶使用低电压恒压电泳,80 V,约30 min;溴酚蓝进入下层胶时使用高压恒压电泳,120 V,至溴酚蓝到达胶的底端处附近即可停止电泳。
玻璃板必须彻底清洗干净,以避免任何残留物对电泳结果的影响。建议使用去离子水冲洗,并确保风干或烤干,以确保电泳过程中的均匀性和一致性。
(1) 配胶时的液体要注意轻轻晃动混匀,以确保胶的质量和稳定性。
(2) 10% APS 应现配现用,避免变质导致胶不聚合。
(1) 加样前样品应先离心,尤其是长时间放置的样品。
(2) 上样时,根据蛋白表达丰度调整蛋白上样量,尽量保证每孔上样量保持一致,且避免样品溢出而污染相临加样孔。
(3) 使用 10 ul 的枪头加样时,注意枪头不要插得太深,避免把玻璃板撑开,致使样品落到胶和玻璃板之间的空隙。
5. 转膜(以湿转为例)
A) 准备转膜缓冲液:提前配制好转移缓冲液并预冷至4 ℃;
B) 准备PVDF膜和滤纸:PVDF膜具有疏水性,使用前将PVDF膜在甲醇中浸泡30 s (从不透明变为半透明),接着用ddH2O冲洗膜表面,最后将膜和滤纸放入转膜缓冲液中;
C) 处理凝胶:轻轻撬开玻璃板,切掉浓缩胶和周围不需要的区域。将凝胶放入转膜缓冲液中,确保胶的完整性;
D) 制备转膜“三明治”(黑胶白膜):三明治夹套的黑色面向下,透明面朝上打开放置在干净的桌面上。从下依次往上放置海绵、滤纸、凝胶、PVDF膜、滤纸、海绵。确保每一层之间都没有气泡,可以在放置最上层泡沫垫前使用滚轮轻轻滚动,以去除气泡;
E) 转膜:将夹套插入转移电泳芯中,确保黑色板朝向黑色板(黑对黑)。然后将转移电泳芯放入转膜槽中,加入足够的转膜缓冲液,确保夹套完全浸没在缓冲液中。设置转膜电流为恒流,220 mA,根据蛋白大小不同设置转膜时间(一般30 kDa以下转30 min,30-70 kDa转60-90 min,70-150 kDa转90-180 min);最好把转膜槽放置在冰浴中进行转膜,避免发热现象。
F) 转膜后处理:转膜完成后,取出PVDF膜,用TBST冲洗膜表面,进行封闭等后续步骤。
(1) 常用的转印膜主要有 PVDF 膜和 NC 膜。
(2) PVDF 膜可以提供更好的蛋白截留率、物理强度和广泛的化学兼容性;可以按照目的蛋白分子量大小进行选择。(MW<20 kDa:0.20 μm; MW>20k Da:0.45 μm)。
(3) NC 膜背景低,价格相对较低。缺点是对于分子量较小的蛋白质会在洗涤时丢失,且NC 膜韧性较差,操作时容易碎,对操作的技巧要求较高。
(1) 对于 PVDF膜,通常需要在甲醇中浸泡 30 s(一定要完全浸湿!)以激活膜上的正电基团,使其更容易与带负电的蛋白质结合。
(2) 对于NC膜则需要在转移缓冲液中平衡一段时间。
(3) 为了方便区分膜的正反,可在膜的右上角进行剪角处理。
按照“滤纸-膜-凝胶-滤纸”的顺序制作转膜“三明治”结构,且注意每一层之间都不能有气泡,否则会影响转膜效果。
注意放置夹套时,胶在负极,膜靠近正极(黑对黑);滤纸不要大过膜,防止短路。
6. 免疫反应
A)封闭:室温下,将转好的膜于摇床上用5%的脱脂牛奶(TBST配制),磷酸化蛋白检测用5%的BSA (TBST配制)缓冲液,室温封闭1-2 h。
B)孵育一抗:稀释一抗(TBST溶解的5 % 脱脂牛奶,磷酸化蛋白使用TBST溶解的5% BSA),4℃过夜孵育。
C)洗膜:按照3次TBST进行洗膜,每次5 min。
D)孵育二抗:一般使用TBST溶解的5%脱脂牛奶,磷酸化蛋白使用TBST溶解的5% BSA室温孵育1-2 h。
E)洗膜:按照3次TBST,1次TBS进行洗膜,每次5 min。
7. ECL显影及数据处理
A) 显影步骤:
l 在避光环境中,将超敏ECL化学发光试剂(Cat#: RA10001)A液、B液1:1配置,充分混匀;将PVDF膜置于化学发光成像仪载物台上;用移液器吸取适量ECL混合液滴在PVDF膜上,确保工作液均匀覆盖在整张印迹膜上;设置曝光时间进行图片采集(可设置不同的曝光时间采集图像,从中选取曝光效果最佳的图像)。
B)数据处理:Western blot结果的半定量分析可以利用灰度分析和光密度分析法,比如利用bio-rad的Quantity One或Image J软件分析。目的蛋白灰度(或光密度)值=目的蛋白灰度(或光密度)/内参蛋白灰度(或光密度)(注:灰度值或光密度值只是一个相对值,不同组间的灰度值对比,反映的是不同组间目的蛋白的变化趋势,并不是绝对定量值)。
三、总结
Western Blot (WB) 作为免疫学核心实验,常因流程复杂、结果不稳定成为科研痛点,且传统WB实验流程需花费1-2天,耗时较长。为此,EnkiLife全新推出的2h极速WB即用型全流程试剂盒(RA10020),不仅将实验时间缩短至2小时,更通过创新设计确保结果高度可重复。
2h极速WB即用型全流程试剂盒验证数据:
1.Western Blot结果对比图:
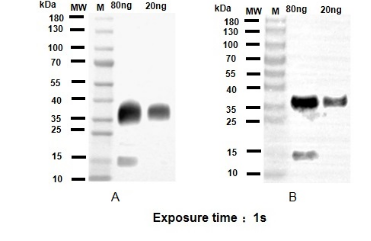
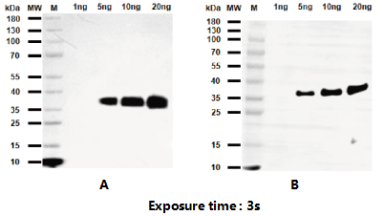
2.样本:重组His-METRNL蛋白(30.7kDa) | 上样量: 80ng、20ng、10ng、5ng、1ng
3. 实验说明:
A组:EnkiLife试剂盒测试结果(三次重复实验)
B组:某品牌试剂盒测试结果(三次重复实验)
l 结论:
A组背景更干净,B组均有轻微背景
A组Marker条带更锐利清晰
A组灵敏度更高,可检测更低丰度样本
A组三次重复实验条带强度CV值仅3.8%

别再让WB的繁琐拖住你下班的腿!
⚡ 2h闪电通关包|⏰ 即开即用/安全免配
实验快一步,打卡快一路!
跑赢夕阳的人,早把移液器换成咖啡杯了~
EnkiLife WB产品推荐:
校准级彩色预染蛋白Marker(8-180kDa)
校准级彩色预染蛋白Marker(10-250kDa)
校准级高分子彩色预染蛋白Marker(25-400kDa)