盐酸托莫西汀(Atomoxetinehydrochloride,商品名择思达)是个用于治疗注意缺陷多动障碍的非兴奋性药物,于2003年由美国礼来公司研发成功并上市。目前已经广泛应用于全球上百个国家。盐酸托莫西汀对突触前膜上的NE再摄取转运体具有高度选择性,是一种去甲肾上腺素再摄取抑制剂(SNRI)。托莫西汀能够抑制NE再摄取并且与其他神经递质的亲和力很低,它的作用是增加突触间隙NE浓度,促进NE的正常传输,并增加额叶皮层中的DA水平,不会增加伏隔核中的DA活性,故不易造成滥用成瘾等副作用,同时它可以增加额叶DA活动并改善患者的认知能力。除此之外,托莫西汀在神经中枢系统中有较长的半衰期,并且它阻断的是突触前NET,每日用药一次便可达到对NET抑制一天的效果,能够对ADHD患者的病情进行平稳的控制。在长期治疗中托莫西汀较其他类药物有更好的疗效,并且随着治疗时间的延长,患者病情的好转程度大大提升。
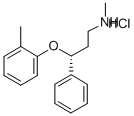
盐酸托莫西汀的合成方法
盐酸托莫西汀作为治疗ADHD的推荐药物,市场需求量大,已有大量研究人员对盐酸托莫西汀的合成工艺进行了报道。盐酸托莫西汀的合成从结构上来看可以简单的分为三个部分,部分是甲胺化以及成盐反应;第二部分是不对称还原手性醇;第三部分是醚化反应。三个部分合成方法的差异导致了合成路线的多样性,具有代表性的有以下几条路线[1]。
以苯甲酰乙酸乙酯为起始原料,使用了bakers酵母进行生物催化不对称还原得到了单一构型的手性醇中间体,再经酰胺化、LiAlH4还原、Boc保护氨基、Mitsunobu反应及脱Boc保护基6步反应得到盐酸托莫西汀。该路线步就涉及到了baker’s酵母进行了生物催化手性还原,该还原方法有一定的立体选择性,但是无法得到单一构型的产品,获得的产物光学纯度较低,最终产品中含有S型约15%。并且生物酶的价格较高,不适合工业生产的开展。在后续反应中使用LiAlH4还原羰基,危险系数较大,工业化制备难度高。
以苯丙醇为起始原料,经过氯化亚砜氯代、N-溴代丁二酰亚胺溴代、与邻甲基苯酚钠醚化、N-烷基化、最后通过S-扁桃酸拆分通氯化氢气体成盐后得到盐酸托莫西汀。该路线选择由邻甲基苯酚与氢氧化钠反应制得邻甲基苯酚钠,再与(1-溴-3-氯丙基)-苯反应,采用钠盐参与反应能够降低反应的要求,使醚化反应的条件更加温和、容易操作。甲胺烷基化反应选择在高压反应釜中进行,通过提高反应温度和压力,反应时长由72h降低到16h,生产效率得到了大幅度提升,能够有效降低生产成本。但是相较于其他合成路线来看,该路线步骤较多复杂繁琐,在工业化生产中损耗较大,降低了整体收率,成本高。
以N,N-二甲基-3-苯基-3-羰基丙胺为起始原料经硼烷还原羰基、氯化亚砜氯代、邻甲基苯酚醚化、溴化氰脱甲基得到外消旋的盐酸托莫西汀。该路线为盐酸托莫西汀的原研路线,总收率较低,并且没有考虑到产品的手性问题,R型盐酸托莫西汀的药效为S型的九倍,所得产品疗效差。在合成过程中氨基醇的氯代反应难以控制,容易生成较多的副产物且后处理复杂,且脱甲基使用的溴化氰为剧毒试剂,产生大量“三废”对环境有严重的污染性,工业上处理困难、增加成本,不符合绿色化学的要求。
以苯乙酮和甲胺盐酸盐为起始原料经过曼尼希反应、硼氢化钠还原羰基、Boc保护氨基、Mitsunobu反应、脱Boc保护基、拆分成盐六步反应得到目标产物盐酸托莫西汀。该路线选用苯乙酮与甲胺进行曼尼希反应,但是在该反应中极易有副产物三级胺的生成,并且副产物难以处理极大的降低了步反应的纯度和收率,影响了该路线整体的生产效率。选择了使用(Boc)2O保护氨基,上保护和脱除操作简单,安全高效。但
Mitsunobu反应收率较低,难以提高。
参考文献
[1]王君婷.盐酸托莫西汀的合成工艺研究[D].济南大学,2021.
