介绍
β-烟酰胺单核苷酸[1,2](nicotinamide mononucleotide,NMN)是动物体内NAD+代谢的中间产物,同时在饮食中也微量存在;相对于烟酰胺(nicotinamide,NAM)、烟酸(niacin,NA)、烟酰胺核糖(nicotinamide riboside,NR)等NAD+前体,β-烟酰胺单核苷酸转化生成NAD+只需要一步催化反应,是最直接高效的前体物质;从酵母到人类都可利用该物质进行NAD+生物合成。目前许多研究表明补充β-烟酰胺单核苷酸对健康有益,在动物实验和人体试验中被用于增加组织中的NAD+水平,减轻与衰老、肥胖及某些病理模型有关的健康缺陷。

图一 β-烟酰胺单核苷酸
β-烟酰胺单核苷酸的代谢途径
在Salvage途径中,β-烟酰胺单核苷酸[3,4]由NAM和PRPP通过哺乳动物NAD+生物合成限速酶NAMPT合成,NMN也可由NR通过NRK介导的磷酸化反应合成;β-烟酰胺单核苷酸由NMNATs催化转化为NAD+。随后,NMN与ATP结合,通过β-烟酰胺单核苷酸AT转化为NAD+。在哺乳动物中,有3种由不同基因编码的β-烟酰胺单核苷酸AT同工酶,即NMNAT1、NMN AT2、NMN AT3,它们分别存在于细胞核、高尔基体和线粒体中。Salvage途径中NAD+消耗酶负责在发挥酶活性作用的同时分解NAD+,如PARPs、Sirtuins、CD38(T10)、CD157(BST1)和SARM1,这些酶降解NAD+并产生NAM作为副产物,并在NNMT作用下甲基化生成MeNAM,并随后进一步分解为Me2PY和Me4PY代谢排出体外。NAMPT是Salvage途径中的限速酶,小鼠全面缺失NAMPT会导致胚胎死亡。此外,在小鼠组织(包括骨骼肌、肝脏和脂肪组织)中NAMPT的组织特异性缺失会降低各器官的NAD+水平。
除主要的Salvage途径外,NAPRT催化Preiss-Handler途径的步,将NA转化为NAMN;而de novo途径则是将Trp转化为QA后,经QPRT催化生成NAMN,两条通路在此合并。再经过一系列反应转化为NAAD后,最终都通过NADs转化为NAD+(图二)。
虽然NAMPT在细胞中具有NADs的作用,但其也在血清中被发现。细胞外形式的NAMPT(eNAMPT)由多种细胞分泌,包括成熟脂肪细胞、胰腺β细胞、肌细胞和肝细胞。据报道,细胞内形态的NAMPT(iNampt)在正常营养状态下在细胞质中被乙酰化。然而,一旦食物稀缺,iNAMPT就会被SIRT1去乙酰化,而提高其酶活性并促进其分泌至胞外。有趣的是,脂肪细胞中NAMPT基因的缺失会降低下丘脑NAD+水平。同样,通过中和抗体去除eNAMPT对下丘脑的NAD+水平也有同样的影响。这些结果表明,eNAMPT可能在血液中产生β-烟酰胺单核苷酸,从而向包括下丘脑在内的各种组织供应β-烟酰胺单核苷酸。然而,另一项研究表明,eNAMPT不参与细胞外N M N的产生,因为血浆中生理浓度的N A M、AT P和PRPP不足以催化NAMPT。因此,eNAMPT在细胞外β-烟酰胺单核苷酸生成中的作用仍存在争议。
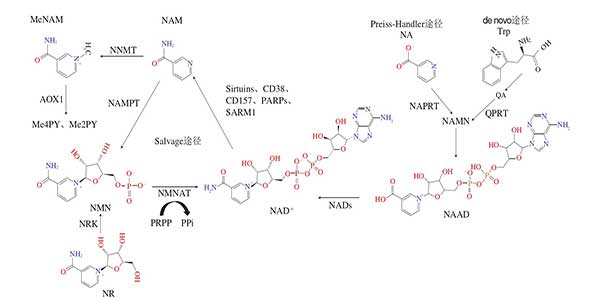
图二 β-烟酰胺单核苷酸的代谢生化途径
细胞对β-烟酰胺单核苷酸的摄取方式
关于β-烟酰胺单核苷酸的摄取与利用[5],通过稳定性同位素标记NMN发现,NMN在细胞外被脱磷酸化为NR,而一项使用多种化学抑制剂的研究表明,NR是通过平衡核苷转运体(equilibrium nucleoside transporters,ENTs)进入细胞。但NR不稳定,在小鼠血浆或含胎牛血清的培养基中可迅速降解为NAM,说明β-烟酰胺单核苷酸在口服进入人体血液后可以在胞外转化为NR,然后被转运进入细胞,但也有一部分在转化为NR后通过肝脏代谢或血液循环中的水解作用转化为NAM。
最近的一项研究发现Slc12a8是β-烟酰胺单核苷酸特异性转运蛋白,Slc12a8可直接跨质膜运输β-烟酰胺单核苷酸,肝细胞中Slc12a8的缺失极大地降低了NMN在肝细胞中的直接吸收。Slc12a8在小肠中强烈表达,可能有助于NMN的口服摄取。因此,血浆中NMN可能有两种进入细胞的方式(图2):一种是通过细胞膜表面的CD73去磷酸化为NR,再通过ENTs进入细胞内,随后再通过细胞质NRK催化为β-烟酰胺单核苷酸,进入线粒体被利用(线粒体无NRK);另一种是直接通过Slc12a8特异性转运体直接进入细胞。NMN的摄取途径可能因组织类型而异。因此,有必要进一步研究不同组织和/或细胞对β-烟酰胺单核苷酸的吸收转运模式。
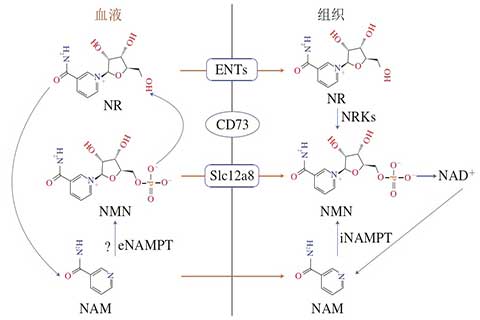
图三 β-烟酰胺单核苷酸进入细胞内的不同途径
生理应用
β-烟酰胺单核苷酸提升组织NAD+水平
许多动物实验表明,长期规律性地补充β-烟酰胺单核苷酸可以有效提高各种外周组织NAD+的生物合成,包括胰腺、肝脏、脂肪组织、心脏]、骨骼肌、肾脏、睾丸、卵巢、视网膜和血管(主动脉)和脑组织,这种提升作用不仅限于正常鼠,也包括饮食诱导的肥胖鼠及其他病理模型鼠。在小鼠的单次急性β-烟酰胺单核苷酸补充实验中,在口服β-烟酰胺单核苷酸(300 mg/kg mb)2.5 min后血浆β-烟酰胺单核苷酸水平增加,并在升高约15 min后降至正常水平,随后肝NAD+水平在30 min逐渐升高。骨骼肌和大脑皮层在在口服β-烟酰胺单核苷酸 60 min后NAD+水平轻度增加。这表明补充的β-烟酰胺单核苷酸可以迅速被机体吸收入血,并在不同的主要器官中快速代谢为NAD+。
在β-烟酰胺单核苷酸的使用剂量与安全性方面,大多数动物实验采用剂量为100~500 mg/(kg mb·d)。最近有研究显示在正常野生型C57BL/6小鼠中,长期(1年)口服β-烟酰胺单核苷酸(300 mg/kg mb)是安全的,耐受性良好,不会产生任何明显的有害或毒性作用[6]。
β-烟酰胺单核苷酸改善糖脂代谢
首先值得注意的是,β-烟酰胺单核苷酸可以显著改善代谢功能。胰腺β细胞对机体NAD+水平下降和β-烟酰胺单核苷酸干预非常敏感,补充β-烟酰胺单核苷酸可以显著增强胰腺β细胞胰岛素分泌和外周组织的胰岛素敏感性,从而改善年龄和饮食诱导的糖尿病小鼠和衰老小鼠的糖耐量和胰岛素抵抗。在脂肪细胞特异性NAMPT敲除小鼠(ANKO)中,口服NMN也会增强脂肪组织NAD+生物合成和SIRT1活性,并使严重的低脂联素血症和多器官胰岛素抵抗正常化。此外,在常规饮食喂养的野生型C57BL/6小鼠中,长期服用NMN可抑制与年龄相关的脂肪组织炎症,并改善全身胰岛素敏感性。考虑到脂肪组织NAD+生物合成在肥胖和老年小鼠中严重受损,这些发现提示脂肪组织NAD+可能是胰岛素抵抗的良好治疗靶点,胰岛素抵抗是2型糖尿病和心血管疾病的重要危险因素。
给药β-烟酰胺单核苷酸还可通过增加能量消耗,部分抑制高脂饮食小鼠的体质量增加,长期服用β-烟酰胺单核苷酸的小鼠表现出更高的能量消耗和身体活动,使得衰老过程中体质量增加受到抑制。因此,使用β-烟酰胺单核苷酸可以改善饮食和年龄相关的体质量增加。
β-烟酰胺单核苷酸调节糖脂代谢,改善组织胰岛素抵抗的主要作用机制包括,恢复NAD+生物合成、增强SIRT1活性、缓解炎症与氧化应激、调节昼夜节律相关的基因表达,增强机体能量消耗[7]。
β-烟酰胺单核苷酸改善线粒体功能
β-烟酰胺单核苷酸可以改善各种代谢器官的线粒体功能,包括骨骼肌、肝脏、心脏和视网膜。NMN处理的小鼠骨骼肌线粒体氧化磷酸化增加,并通过增加全身能量消耗促进减肥。在高脂饲料喂养的肥胖小鼠中增加肝脏线粒体中柠檬酸合酶活性[8]。
β-烟酰胺单核苷酸的抗衰老作用
长期服用β-烟酰胺单核苷酸可改善年龄相关的胰岛素抵抗,并减缓随年龄增长而发生的基因表达变化。老年小鼠给予β-烟酰胺单核苷酸后,骨骼肌线粒体呼吸能力也能较好地保持,这将有助于提升机体能量消耗,改善糖耐量。
补充NMN还有助于缓解衰老雌性小鼠的生殖能力下降,研究发现,在生育能力下降小鼠的卵母细胞中,添加β-烟酰胺单核苷酸可以增加其NAD+和NAD(P)H水平。β-烟酰胺单核苷酸处理小鼠也表现出生育力增强和卵母细胞产量增加,以及产仔数和活仔数的改善。NMN治疗老龄小鼠也能对脑功能产生类似的逆转作用,可以改善老龄小鼠的空间工作记忆功能和步态协调,这可能与Sirtuins介导的神经细胞与血管内皮细胞的转录组学变化有关[9]。
参考文献
[1]陈韬,曹卉,董丽,吉喆,曹建民.β-烟酰胺单核苷酸对生理机能影响的研究进展[J].食品科学,2023,44(09):382-391.
[2]陈宇娴,周楚然,黄建忠,等.β-烟酰胺单核苷酸的生理活性与合成研究进展[J].生物工程学报,2023,39(02):516-536.
[3]周爱,张佳丽,董文兴,等.β-烟酰胺单核苷酸的合成研究进展[J].台州学院学报,2022,44(06):57-63.
[4]任丽梅,王晓茹,祁永浩,等.β-烟酰胺单核苷酸功能与合成研究进展[J].生物资源,2021,43(02):127-132.
[5]史海波,赵海,周春松,王泉明.β-烟酰胺单核苷酸制备研究进展[J].精细化工中间体,2020,50(04):1-5.
[6]KOVER K,TONG P Y,WATKINS D,et al.Expression and regulation of NAMPT in human islets[J].PLoS ONE,2013,8(3):e58767.
[7]GROZIO A,MILLS K F,YOSHINO J,et al.SIc12a8 is a nicotinamide mononucleotide transporter[J].Nature Metabolism,2019,1(1):47-57.
[8]ROH E,KIM M S.Hypothalamic NAD+-sirtuin axis:function and regulation[J].Biomolecules,2020,10(3):396.
[9]FOUQUEREL E,SOBOL R W.ARTD1(PARP1)activation and NAD+in DNA repair and cell death[J].DNA Repair,2014,23:27-32.
