856866-72-3
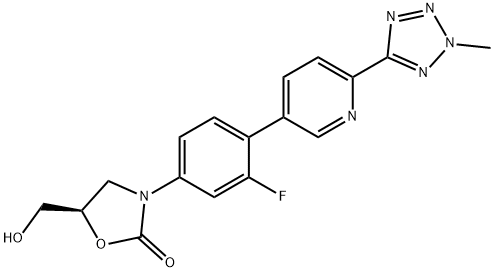 856866-72-3 结构式
856866-72-3 结构式
基本信息
特地佐利
泰地唑利
特地唑胺游离碱
磷酸特地唑胺TR-700
特地唑胺 TEDIZOLID
TEDIZOLID
TR-700
DA-7157
(R)-3-(4-(2-(2-甲基四唑-5-基)吡啶-5-基)-3-氟苯基)-5-羟甲基噁唑烷-2-酮
3-[3-氟-4-[6-(2-甲基-2H-四唑-5-基)-3-吡啶基]苯基]-5-(羟基甲基)-2-恶唑烷酮
(5R)-3-[3-氟-4-[6-(2-甲基-2H-四唑-5-基)-3-吡啶基]苯基]-5-(羟甲基)-2-噁唑酮
DA 7157
Tedizolid
Torezolid
Torezolid (TR-701
Tedizolid (TR-701)
Tedizolid Impurity7
Tedizolid free base
Specially acetazolaMide
(R)-3-(3-Fluoro-4-(6-(2-methyl-2H-tetrazol-5-yl)pyridin-3-yl)phenyl)-5-(hydroxymethyl)oxazolid
物理化学性质
制备方法
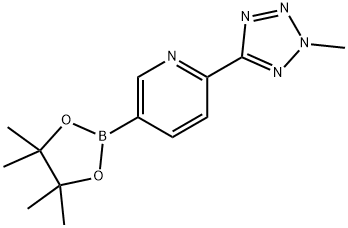
1056039-83-8
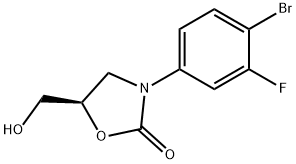
444335-16-4

856866-72-3
在氮气保护下,向反应容器中依次加入1,4-二恶烷(400 mL)、5-溴-2-(2-甲基-2H-四唑-5-基)吡啶(20.0 g,83.3 mmol,1.0当量)、双(频哪醇)二硼(25.3 g,100 mmol,1.2当量)、乙酸钾(20.4 g,208 mmol,2.5当量)和双(三苯基膦)二氯化钯(1.17 g,1.4 mmol,0.015当量)。将反应混合物加热至回流,并通过TLC监测反应进度,以5-溴-2-(2-甲基-2H-四唑-5-基)吡啶为参照。反应完成后,冷却至20°C以下。随后,向反应容器中依次加入(5R)-3-(4-溴-3-氟苯基)-5-羟甲基恶唑烷-2-酮(21.7 g,75.0 mmol,0.9当量)、碳酸钾(34.5 g,250 mmol,3.0当量)、钯乙酸盐(0.14 g,0.62 mmol,0.0075当量)和三苯基膦(0.65 g,2.5 mmol,0.03当量),并在氮气保护下升温至回流。通过TLC追踪2-(2-甲基-2H-四唑-5-基)-5-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)吡啶的反应进度直至完成。反应完成后,冷却至室温并搅拌16小时。减压过滤,滤饼依次用水(200 mL)和甲醇(200 mL)洗涤。收集滤饼并在80°C下风干,得到25.8 g目标产物(R)-3-(3-氟-4-(6-(2-甲基-2H-四唑-5-基)吡啶-3-基)苯基)-5-(羟甲基)恶唑烷-2-酮(化合物I),为灰白色粉末,收率为84%。
参考文献:
[1] Patent: CN107382995, 2017, A. Location in patent: Paragraph 0007; 0014; 0015; 0016; 0117; 0018; 0019-0022
[2] Patent: CN106146485, 2016, A. Location in patent: Paragraph 0040; 0041; 0042
[3] Patent: CN105418681, 2016, A. Location in patent: Paragraph 0048; 0049
[4] RSC Advances, 2016, vol. 6, # 63, p. 58088 - 58098
常见问题列表
磷酸特地唑胺(Tedizolid phosphate)是由Dong-A Pharmaceutical研发一种第二代恶唑烷酮类抗生素,授权Cubist Pharmaceuticals和 Bayer进行商业化开发。
Sivextro旨在治疗严重或危及生命的感染,其上市申请被授予合格感染疾病产品(QIDP)资格,并获得了FDA的加快审评。Sivextro的QIDP资格使这款药物除了拥有《食品、药品和化妆品法案》赋予的市场独占权之外,还可以拥有额外5年的市场独占权。
Sivextro的安全性及有效性在1315名ABSSSI成人患者参与的两项临床试验中得到评价。受试者被随机配给Sivextro或另一种获批用于治疗急性细菌性皮肤和皮肤结构感染(ABSSSI)的抗菌药物利奈唑胺。结果显示,其临床效果与利奈唑胺相当,在胃肠道和血小板减少方面的不良反应要比利奈唑胺少,耐药性的发生率也更低。有试验显示特地唑胺的耐受性也优于万古霉素。
临床试验中证实的最常见副作用有恶心、头痛、腹泻、呕吐和头晕。Sivextro的安全性和有效性尚未在白细胞水平降低(嗜中性白血球减少症)的患者中进行评价,所以应该考虑替代疗法。Sivextro由位于马萨诸塞州列克星敦市的Cubist制药上市销售。
知识产权状况:化合物专利ZL200480037612.2,保护期2024.12.17届满。
本信息由Chemicalbook晓楠编辑(2015-08-14)。
2013年8月9日,拜耳医药已经向CFDA提交新药申请。
(二) 国内专利
1.化合物专利
东亚制药在中国申请了该化合物专利,申请号为ZL200480037612.2,申请日为2004年12月17日,保护期2024.12.17届满。随后又提交了3项分案申请,申请号分别为201010508824.1(制剂),201110304983.4,201210155386.4。
2009年10月9日,特留斯治疗学公司申请了制备方法专利,申请号为200980140144.4。
2. 晶型专利
2010年2月3日,特留斯治疗学公司申请了游离酸的晶型专利,申请号为201080014363.0。公开游离酸的晶型I具有比二钠盐更稳定且具有不吸湿的优点。
3.制剂组合物专利
上述专利200480037612.2及其分案申请专利公开了特地唑胺粉剂、片剂、胶囊剂及注射剂型。
上述专利201080014363.0公开了特地唑胺片剂及冻干制剂的处方。
