背景及概述[1]
芋螺属腹足纲前腮亚纲芋螺科的软体动物,全世界约有700-1000种,多数生活在热带海洋的浅水区,根据其食性可分为食鱼、食虫、食螺3种类型。芋螺毒素由芋螺毒液管和毒囊内壁的毒腺所分泌,每种芋螺的毒液中至少含50~200种活性多肽(最近的研究结果显示活性多肽种类更多),能特异性地作用于钾、钠、钙等多种离子通道及细胞膜上的各种受体,从而影响细胞或神经中的信号传递。芋螺毒素由含70-120个氨基酸残基的前体肽加工而来,前体肽含信号肽、Pro区及成熟肽区。成熟肽一般含13-46个氨基酸及多对二硫键,同一超家族的芋螺毒素信号肽高度保守,成熟肽则超变异。根据芋螺毒素高度保守的信号肽序列及二硫键骨架,将芋螺毒素分为A、B1、B2、B3、C、D、E、F、G、H、I1、I2、I3、J、K、L、M、N、O1、O2、O3、P、S、T、V、Y等26个超家族,再根据每个成员保守的半胱氨酸骨架及其药理学作用靶点,进一步可分为α、μ、ω、κ、δ、ψ、σ、ρ、γ、加压素、惊厥剂和睡眠肽等家族。
分类及分子生物学特征[2]
芋螺属于腹足纲软体动物,分布于热带海洋中的浅水区.据估计全世界有500多种芋螺,我国有百余种.每种芋螺的毒液中含50~200种活性多肽,而且不同种的芋螺所含的活性多肽也各不相同,因而理论上应有5万多种活性肽组分存在于芋螺毒液中.迄今,它们中已被阐明的仅百余种,多数由12~46个氨基酸残基组成,含两对或三对二硫键,包括了至今发现的最小神经肽毒素.它们作用靶点广泛,能结合细胞膜上神经递质和激肽的受体和各种离子通道.籍此它们能干扰神经或其他细胞中的信号传递,具有很强神经毒性.比如α、αA和ψ-CTx能分别竞争性和非竞争性拮抗N型ACh受体,ω-CTx选择性抑制突触前的N型电压敏感性Ca2+通道,κA和κ-CTx选择性抑制电压敏感性K+通道,而μ、μO和δ-CTx则选择性作用于电压敏感性Na+通道.另外还有一些芋螺毒素,它们能选择性作用于血管加压素受体(conopressin)、NMDA受体(如conantokin)和5-羟色胺的3型(5-HT3)受体(如σ-CTx)[1].芋螺在捕食时利用毒液中的活性成分来阻断神经肌肉间兴奋信号的传递,整个捕食过程可分为两个时相:快时相(兴奋性休克)和紧接着的慢时相(神经肌肉间兴奋信号传递的阻断).前者主要由于δ-CTx延迟电压敏感性Na+通道的失活及κA和κ-CTx选择性抑制电压敏感性K+通道,从而使细胞异常兴奋,造成被食者瞬间休克而无法动弹.后一时相则主要由于ω-CTx通过抑制突触前N型电压敏感性Ca2+通道来抑制神经递质的释放,α和ψ-CTx直接阻断突触后膜上的ACh受体及μ-CTx对骨骼肌细胞上电压敏感性Na+通道的抑制,进而完全阻断神经肌肉间的兴奋传递,使被食者肌细胞动作电位无法产生而造成麻痹.慢时相涉及多种毒素的协同作用,需要相对较长时间.快时相正好为慢时相中相关毒素到达靶点并发挥阻断作用提供缓冲时间。
芋螺毒素的种类繁多,生物活性多样,一级结构多变,需要有一简单合理的分类和命名.对它们的分类,目前主要采用如下原则:按每个成员保守的二硫键骨架和高度保守的前导肽序列,并结合其药理学活性,将芋螺毒素分为若干个超家族和家族。它们的命名则综合以下的一些规则.比如同一个超家族的成员具有相似且独特的二硫键骨架和高度保守的信号肽序列;一个已知功能的芋螺毒素的最终命名包括一个希腊字母(表明药理学活性),一个连字号用于连接“conotoxin”单词,一或两个字母,一个罗马数字(指明二硫键骨架和配对方式)及一个大写字母(代表一个特异肽的变异体).如ω-conotoxinGⅥA中,ω指出药理学活性,G代表芋螺种属,Ⅵ为二硫键骨架类型,而A为肽的特殊变异体.当还不知某个肽的功能时,名称上就没有用于指出药理学活性的希腊字母,而仅用一或两个小写字母代表芋螺种属,一个阿拉伯数字表明二硫键骨架和配对方式,或再加上一个小写字母代表肽的特殊变异体,如tx5a.一旦它的功能得到阐明,就将采用前一种命名方法获得的名称.如果出现功能相同而二硫键骨架和配对方式不同的芋螺毒素则在名称中的希腊字母后加个大写字母予以区分,如都作用于AChR的α与αA和均能抑制钾通道的κ和κA等.其余的活性多肽由于数量少且分布的芋螺种属也相对窄,往往在名称后加一或两个用于表明来源芋螺种属的字母即可,如conopressin-S、contryphan-R、contulakin-G等。
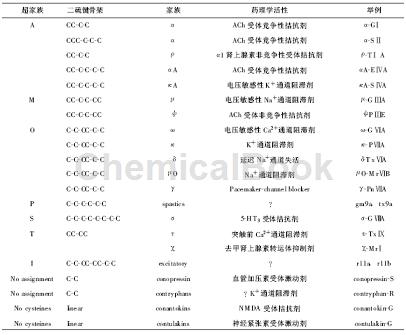
虽然芋螺毒素种类繁多,它们的cDNA序列分析却发现有很多共同点.大多数芋螺毒素均来自一个由70~120个氨基酸残基组成的多肽前体.此前体可分为三个区域:Pre区(信号肽)、Pro区(前体肽)和成熟肽区,并且在结构基因上被内含子所间隔.其Pre区由N端的约20个氨基酸残基组成,而成熟肽区由C端的12~46个氨基酸残基组成.同一超家族中的不同芋螺毒素,即便来源于不同的芋螺种属,它们的Pre、Pro区均高度保守,而成熟肽区却超变异.这超变异正是芋螺毒素分子多样性的基础.例如来源于地纹芋螺(C.geographus)的ω-CTxGⅥA和来源于幻芋螺(C.magus) 的ω-CTxMⅦA的前体,它们的Pre区和Pro区高度同源,而成熟肽区除二硫键骨架保守外,几乎全不相同.这类似于人体内的抗体结构(包含一个恒定区和一个针对不同抗原演变而成的可变区).由于不同芋螺的食性和所处环境不同,它们的成熟肽可能随着进化而演变为不同的结构.

药理学活性[2-3]
1.ACh受体拮抗剂
乙酰胆碱(ACh)受体按药理学可分为N型和M型,其中N型ACh受体(nAChRs)属于配体门控通道型.α-CTx因具有蛇毒中α神经毒素的相似功能,能选择性拮抗nAChRs而得名.它通过结合神经肌肉接头处突触后膜上nAChRs的α亚基而阻断神经肌肉间兴奋信号的传递,并且这种作用可被α-银环蛇毒所竞争.近年来α-CTx已成为研究AChRs的理想工具,因为它不仅可区分N型和M型的AChRs,而且还能进一步细分nAChRs的肌肉型和神经型.迄今已报道的α-CTx有20余种,除αA-P ⅣA、EⅣA和α-SⅡ含三对二硫键外,其余均含两对二硫键并呈交叉分布(C1-C3,C2-C4),中间形成两个Loop(Loop1和Loop2).保守的二硫键骨架和Loop长度是α-CTx的一个主要特征.Loop1/Loop2大小为3/5(氨基酸残基之比)的α-CTx (α-EⅠ除外,其值为4/7),能专一结合肌肉型nAChRs的α/δ和α/γ亚基,Loop1/Loop 2大小为4/7或4/3的,则专一结合神经型nAChRs的α3β2、α3β4和α7亚基.通过进一步比较发现,针对肌肉型nAChRs的α-CTx的Loop区序列同源性很高,而针对神经型的却变化很大.α-CTx在溶液中的肽骨架构象近似“ω”形,此“ω”两端分别代表C端和N端,开口大小表示C端和N端的接近程度.由于每种α-CTx的一级结构不同,其三级结构也表现为以“ω”刚性结构为骨架,再附加多种柔性的结构.它们对AChRs各种亚型结合的高度选择性和专一性正是由这些柔性结构所赋予.如α-PnⅠA的Ala10Asn11被α-PnⅠB的Leu10Ser11取代后,其作用位点就由AChRs的α3β2亚基变为α7亚基.类似地,由12个残基组成的α-CTxImⅠ和ImⅡ,虽然有9个残基一致,却只有前者能与α-银环蛇毒竞争结合nAChRs的α7亚基。有意思的是,最近报道具有特殊二硫键连接方式(C1-C4,C2-C3)的α-CTxAuⅠB对大鼠副交感神经元AChRs的拮抗作用要比其天然形式(C1-C3,C2-C4)强10倍.这还是芋螺毒素中非天然的二硫键异构体比天然的具有更高生物活性的首例报道.此外,还有另两个家族的成员也能作用于AChRs:具有独特的二硫键骨架(C1-C5,C2-C3,C4-C6)的αA-PⅣA和EⅣA能竞争性结合骨骼肌上AChRs的α7亚基;ψ-CTxPⅢE以非竞争性方式选择性地拮抗nAChRs,并不为α-环蛇毒素所竞争,其二硫键骨架与α和αA-CTx不同,却与抑制钠通道的μ-CTx相似.
2. 离子通道的阻断剂或激动剂
1)钙离子通道阻断剂:电压敏感性Ca2+通道(VSCCs)可分为T、L、N、P、Q和R型.其中L型参与一些兴奋-收缩/分泌偶联和心肌的活动,而N、P、Q和R型参与神经递质的释放.ω-CTx是一类能选择性作用于VSCCs某种亚型的芋螺毒素.如ω-CTxTxⅦ选择性抑制L型VSCCs,而ω-CTxMⅦA只抑制N型VSCCs.大多数ω-CTx由24~29个氨基酸残基组成,分子中含有三对二硫键及4个Loop,C端常被酰胺化.最初在将粗芋螺毒素注射入小鼠颅腔观察各种行为征状时,发现有的可导致小鼠摇晃(shaker),并将此活性成分称为“Shaker”肽.后来证实,此“Shaker”肽即为ω-CTxGⅥA和MⅦA.ω-CTx具有很强的组织专一性,它们多数只作用于神经元而不作用于肌细胞(对神经元和肌细胞的亲和力之比有的可达108∶1),并能选择性抑制突触前N型VSCCs,从而抑制神经递质的释放.ω-CTx在空间结构上表现为由三股被转角连接的反平行β片层所组成,具有稳定的抑制剂半胱氨酸绳结模体(inhibitorcysteineknotmotif,ICKmotif)的结构.这种保守结构正是ω-CTx能作用于VSCCs上宏位点(macrosite)的基础(即它们均具有抑制VSCCs的活性),而它们对VSCCs的结合特点及对VSCCs特定亚型的选择性(即对microsite的识别)则归功于分子中4个Loop区氨基酸序列的超变异.如ω-CTxMⅦA和GⅥA均能抑制N型VSCCs,但前者对VSCCs的结合是可逆的,而后者却不可逆.ω-CTxTxⅦ虽也能作用于VSCCs,但只能抑制L型.最近,从芋螺C.consors毒液中分离到的在loop4中有一特殊序列(Ser-Ser-Ser-Lys-Gly-Arg)的ω-CTxCnⅦA,虽能抑制嗜铬细胞N型VSCCs,却不具备ω-CTxGⅥA所具有的抑制神经肌肉接头处ACh释放的活性.副交感神经元的神经递质释放不被上述ω-CTx所抑制,而ω-CTxCⅥD却能抑制颌下副交感神经元胆碱能神经的递质释放.这些提示了N型VSCCs还可能被进一步细分为各种亚型,而含有特殊序列的ω-CTx则有望作为鉴定这些亚型的探针.鉴于以上特点,ω-CTx已被广泛用作VSCCs的探针工具,为神经生物学研究作出很大贡献.另一属于T超家族的ε-CTxTxⅨ,亦能通过阻断突触前VSCCs而抑制神经递质的释放,其二硫键骨架为CC-CC,分子中含有丰富的翻译后加工(如Trp溴化、Pro羟基化、Thr糖基化及γ-羧基谷氨酸).
2)钠离子通道阻断剂或激动剂:电压敏感性Na+通道(VSSCs)可分为神经型(Ⅰ、Ⅱ和Ⅲ型)和肌肉型(骨骼肌M1型和心肌M2型),其典型阻断剂包括河豚毒素(TTX)和石房蛤毒素(STX).Na+通道上至少有6个结合位点,与TTX和STX一样,μ-CTx也通过结合SiteⅠ发挥阻断作用,因而它们可相互竞争.δ-CTx却通过结合SiteⅥ而使通道失活减慢.μO-CTx的结合位点不同于上述两类芋螺毒素.δ和μO -CTx与钙通道阻断剂ω-CTx同属于O超家族,它们分子内三对二硫键也形成ICK模体.而μ-CTx的二硫键骨架与δ和μO-CTx完全不同,其属于另一超家族超家族.在空间构型上,它不形成ICK模体,而具有由一段α螺旋、一个β发夹和几个转角所组成的紧密CSαβ模体(cysteinestablilizedαβmotif).
μ-CTx是一类分子中常含有羟脯氨酸的芋螺毒素,至今已阐明的共有5种,它们多数均能选择性作用于TTX敏感的VSSCs.μ-CTxGⅢA是此家族中个被发现的成员,也具有很强的组织专一性,能高度选择性抑制TTX敏感的骨骼肌上VSSCs的NaV1.4亚型而不作用于肌肉上的其他亚型和神经型的VSSCs.有意义的是,最近从C.stercusmuscarum发现到的μ-CTxSmⅢA却能阻断两栖类动物交感神经元和感觉神经元上TTX不敏感的VSSCs,这是来自芋螺的个能选择性抑制TTX不敏感VSSCs的芋螺毒素.μ-CTxSⅢA是我们最近从线纹芋螺C.striatus中发现的,其也能选择性抑制大鼠背根神经节细胞上TTX不敏感的VSSCs(未发表数据).鉴于TTX不敏感VSSCs在痛觉中发挥着重要作用,μ-CTxSmⅢA和SⅢA有望作为先导化合物用于新药的开发.来源于食软体动物芋螺C.pennaceusμ –CTxPn ⅣA和PnⅣB,虽也能阻断软体动物神经元上的VSSCs,但它们二硫键骨架很特殊,既不属于O也不属于M,而属于A超家族.这正说明了不同结构的芋螺毒素可具有相似的活性.μ-CTx因能选择性结合VSSCs而对Na+通道的研究作出很大贡献,如VSSCs的4个同源性结构域在细胞膜上的排列形式就是借助μ-CTxGⅢA才得以阐明。另一同属于M超家族的μ-CTxPⅢA的作用靶点相对广泛,它不仅可作用于肌肉型VSSCs,也可作用于神经型.据此推测,VSSCs的各种亚型可能藉μ-CTx被进一步鉴定[18].属于另一超家族的μO-CTx中目前只发现两个成员分别为μO-CTxMrⅥA和MrⅥB,它们也能阻断软体动物神经元上的VSSCs,前者还能抑制大鼠大脑神经元上的VSSCs.
δ-CTx对芋螺捕食时的快时相起着重要作用.它虽与ω-CTx具有相同的二硫键骨架,却并不作用于VSCCs,而是延迟VSSCs的失活.这从另一角度说明,相似结构的芋螺毒素可表现为不同的生物活性.来源于食软体动物芋螺C.gloriamaris的δ-CTxGmⅥA,是个从芋螺毒液中分离纯化到,并能延迟软体动物神经元VSSCs失活的兴奋性毒素.而来源于食鱼芋螺C.purpurascens的δ-CTxPⅥA是个被报道能作用于脊椎动物的δ-CTx.另一兴奋性毒素δ-CTxTxⅥA,虽对大鼠神经元有高亲和力,但脊椎动物注射后并不能引起明显反应.δ-CTxNgⅥA(来源于C.nigropunctatus)的序列与δ-CTxTxVIA(来源C.textile)很相似,它们能相互竞争结合软体动物和大鼠神经元上的VSSCs,但只有前者不仅能延迟软体动物神经元上VSSCs失活,还能造成脊椎动物麻痹.这说明两者在VSSCs上的结合位点既有重叠,又不尽相同.
3)钾离子通道选择性阻滞剂:电压敏感性钾通道(VSPCs)在生理和病理条件下均发挥着重要作用,可分为外向整流、内向整流、瞬时钾通道和钙激活钾通道四类.κ和κA-CTx能选择性抑制VSPCs,也是对芋螺捕食的快时相有重要贡献的一类主要组分.它们的药理学活性虽然相似,但两者的二硫键骨架完全不同,且属于不同超家族,前者属于O超家族,而后者为A超家族.这也同样说明,不同结构的芋螺毒素可具有相似的活性.κ-CTxPⅦA是个被发现能阻断钾通道的CTx,也是芋螺毒素中研究最多的钾通道阻滞剂,它能选择性结合并阻断瞬时钾通道.κ-CTxPⅦA也具有ICK模体,分子中Lys7和Phe9残基对其结合并封闭钾通道孔区起重要作用.κA-CTxSⅣA作为芋螺毒素中个被发现分子内存在糖基化修饰的毒素,含三对二硫键,也能抑制VSPCs并引起鱼和蛙的痉挛性麻痹.最近,从芋螺C.radiatus毒液中纯化到的κM-CTxRⅢK,其二硫键骨架虽与μ-CTx相同,但它并不作用于钠通道而表现为抑制TSha1(teleosthomologofShaker)钾通道.
3. 5-HT3受体拮抗剂
5-羟色胺(5-HT),又名血清紧张素(serotonin),其受体可分为G蛋白偶联型(如5-HT1受体)和配体门控离子通道型(如5-HT3受体).5-HT3受体广泛分布于中枢和外周神经系统,参与许多生理病理等过程,如调节血管的舒张和胃肠道平滑肌的紧张性及腺体的分泌,诱发疼痛和恶心呕吐,还与焦虑症及药物戒断症状等相关.属于S超家族的σ-CTxGⅧA是此超家族中迄今被发现的唯一成员,它能竞争性并高度选择性地拮抗5-HT3受体.鉴于5-HT3受体的内源性配体就是Trp的羟基化衍生物,σ-CTxGⅧA分子中的溴化Trp可能对其发挥拮抗作用有着很大贡献.有意思的是,在芋螺C.imperialis毒液中也检测到有相当浓度水平的5-HT,至于其对芋螺自身或在捕食过程中的具体作用仍未见任何报道[26].
4. NMDA受体拮抗剂
谷氨酸是中枢神经系统中重要的兴奋性神经递质.其受体可分为配体门控离子型和G蛋白偶联型,前者可进一步细分为NMDA(N-methyl-D-aspartate)型和非NMDA型.其中NMDA受体对钙离子有很高选择通透性,它参与中枢神经系统的发育,并与神经元存活和突触可塑性等有着密切关系,在学习、记忆以及神经回路形成过程中也起重要作用.但神经细胞损伤和死亡.芋螺毒素中conantokin家族,在药理学上就表现为NMDA受体的选择性拮抗剂.Conantokin,又“Sleeper/climber”肽,迄今发现四个成员:conantokin-G,T,R和L.它们分子中均富含γ-羧基谷氨酸(Gla),在序列上也具有很高同源性,且N端部分序列完全一致.Conantokin因能选择性拮抗NMDA受体而在神经元损伤和死亡中具有神经保护作用,引起了人们极大兴趣.Conantokin-G能非竞争性拮抗NMDA受体,成年小鼠大脑注射后,可诱发活动过度症状.若仅将conantokin-G分子中的Gla全部置换为Glu(即形成Glu- conantokin-G),则维生素K依赖性羧化酶很难再将Gluconantokin-G分子中的Glu加工成Gla,而一旦在Glu-conantokin-G的N端接上其前体肽的pro区(-Prog. Biochem.Biophys.·541·20至-1)则羧化酶对它的亲和力明显增强.这提conantokin-G前体的pro区可能对其翻译后的羧基化加工起重要作用.Conantokin-T能通过抑制由中枢神经元上NMDA受体介导的钙内流而引起小鼠睡眠样征状.经conantokin G的序列比较,提示conantokin-T分子中的4个Gla和N端的两个残基可能对发挥活性起重要作用.Conantokin-R是此家族中迄今被发现的唯一一个分子中含有二硫键的成员,也能非竞争性拮抗NMDA受体,并具有很强抗惊厥/癫痫作用.最近从芋螺C.lynceus纯化到同样表现为NMDA受体非竞争性拮抗剂的conantokin-L,其序列(除C端外)与conantokin-R有很高同源性,但抗惊厥/癫痫作用却明显不如后者,这提示conantokin-R的C端序列可能对其发挥抗惊厥/癫痫作用有很大贡献.
5. 血管加压素
血管加压素,又称抗利尿素,由下丘脑视上核和室旁核神经元分泌并经下丘脑垂体束被运送到垂体后叶贮存.在适当刺激下释放入血液,具有抗利尿和升高血压等生理作用.芋螺毒素中的conopressin,又称“Scratcher”肽,就是G蛋白偶联型血管加压素受体的激动剂.早在1987年就从芋螺毒液中纯化Lys-conopressin-G和Arg-conopressin-S,它们均带正电荷.这类毒素在小鼠脑室注射后可引起与注射神经垂体激素相似的征状,如Lys-conopressin-G可引起小鼠抓搔和梳理毛发等.芋螺毒液中存在此类调节血压的毒素,它们在芋螺捕食时是否通过调节血压来促进其他毒素发挥作用,迄今还未见有报道.
6. 神经紧张素
contulakin家族,又称“sluggish”肽,是G蛋白偶联型神经紧张素受体的激动剂.此家族中的contulakin-G,分子中含有糖基化修饰,其C端序列与神经紧张素有很高同源性.小鼠脑室注射contulakin-G后可造成脑区中与运动控制相关的功能受到障碍,引起懒散征状.
7. 其他
contryphan是一类分子内含D型Trp或Leu的芋螺毒素,目前已阐明的9个成员均含一对二硫键.它们中有些组分可引起小鼠竖尾(stiff-tail)综合征,但具体机制仍不清楚.contryphan-R与contryphan-R/Tx,虽然它们前体中的Pre区、Pro区有些差别,但成熟肽完全一致.在不同种属芋螺中存在完全一样的芋螺毒素,这还是首次报道.Leu-contryphan-P是芋螺毒素中个被报道含D型Leu的组分,而contryphan-Vn则是个从食虫芋螺的毒液中分离到的含D型Trp成员.来源于芋螺C.radiatus的8肽,bromocontryphan,可能是蛋白质翻译后加工最复杂的一个成员.λ-CTx家族包括CMrⅥA、CMrⅥB和CMrⅩ,这三者均来源于芋螺C.marmoreus它们的二硫键骨架(CC-C-C)虽与α-CTx相似,但配对的方式完全不同(为C1-C4,C2-C3),空间结构上也呈独特的丝带状.小鼠脑室注射后可引起明显的生物学效应,比如癫痫发作(如CMrⅥA)和弛缓性麻痹(如CMrⅩ).P超家族的芋螺毒素gm9a和tx9a,两者结构相似,也具有ICK模体,能造成小鼠痉挛.从幻芋螺(C.magus)的毒液分离纯化到的conodipine-M,由119个残基组成,与已知PLA2s的同源性很低,具有磷脂酶A2(PLA2s)活性而没有三酰基/二酰基甘油脂肪酶和磷脂酶B的活性.
去甲肾上腺素是中枢和外周神经系统的重要神经递质.能与去甲肾上腺素或肾上腺素结合的受体统称为肾上腺素受体(adrenoceptors),可分为α型受体(有α1和α2亚型)和β型受体(有β1和β2亚型).最近从芋螺C.tulipa毒液中纯化到的ρ-TIA和从芋螺C.marmoreus毒液中纯化到的χ-MrⅠA、χ-MrⅠB,它们能分别阻断α1肾上腺素受体和去甲肾上腺素转运蛋白,从而影响去甲肾上腺素发挥作用.12肽的conorfamide-Sr1是新近在大西洋芋螺C.spurius毒液中发现的,属于Rfamide家族的神经肽,分子中没有二硫键.来源于芋螺C.radiatus的conophysin-R,属于神经垂体素运载蛋白家族,是个从无脊椎动物毒液中纯化到具有此类生物活性的组分.它由84个残基组成,分子内含7对二硫键,也是迄今已发现的芋螺毒素中含二硫键最多的成员.
主要参考资料
[1] 几类新家族芋螺毒素研究进展
[2] 芋螺毒素研究进展
[3] 芋螺毒素的毒理学和药理学研究
