【背景及概述】[1][2][3]
浓硫酸为无色油状液体,常用浓硫酸溶质质量分数为98%,沸点为338℃,高沸点,难挥发,能夺取纸张、木材、布料、皮肤中的水分,生成黑色的碳,具有一定腐蚀性;能与水任意比例混溶,溶于水,剧烈反应,常作某些气体的干燥剂。硫酸是一种具有高腐蚀性的强矿物酸,一般为透明至微黄色,在任何浓度下都能与水混溶并且放热。有时,在工业制造过程中,硫酸也可能被染成暗褐色以提高人们对它的警惕性。作为二元酸的硫酸在不同浓度下有不同的特性,而其对不同物质,如金属、生物组织、甚至岩石等的腐蚀性,都归根于它的强酸性,以及它在高浓度下的强烈脱水性、吸水性与氧化性。硫酸能对皮肉造成极大的伤害,因为它除了会透过酸性水解反应分解蛋白质及脂肪造成化学烧伤外,还会与碳水化合物发生脱水反应并造成二级火焰性灼伤;若不慎入眼,更会破坏视网膜造成永久失明。故在使用时,应做足安全措施。硫酸容易潮解,会吸取空气中的水蒸气。工业用浓硫酸含量一般为98%,但在不同行业应用时通常需要稀释到低浓度,如硫酸法二氧化氯发生工艺使用的硫酸原料通常需要60%左右或者77%左右,此浓度的硫酸的购买、运输、存储均存在一定问题。目前常用硫酸稀释设备存在以下问题:1)硫酸稀释放热可能导 致局部温度过高,腐蚀设备,并且产生大量的酸雾影响环境。2)传统搪瓷混合搅拌稀释方法 热点难控制,危险性高;属于间歇性稀释工艺,产品浓度难以控制并且耗能高,噪音大。3)其他形式硫酸稀释器存在设备成本高、使用寿命短、维护困难或者耐酸能力低、易泄露等问题。
【稀释方法】[2]
一种浓硫酸稀释方法,包括以下步骤:
1)浓硫酸和水分别通过浓硫酸流量计和水流量计进入到浓硫酸稀释器中,在浓硫酸稀释器中进行均匀混合并快速稀释;
2)浓硫酸稀释器将稀释后的硫酸注入到稀释硫酸冷却器中进行冷却;
3)稀释硫酸冷却器将冷却到常温的稀硫酸注入到稀硫酸储罐中待用;
4)浓硫酸稀释器在稀释过程中产生的硫酸雾进入到硫酸雾捕集器中,硫酸雾捕集器对硫酸雾进行冷却处理,然后进入到硫酸雾洁净器 进行洁净处理,硫酸雾捕集器及硫酸雾洁净器处理后生成的硫酸返回 到原浓硫酸中;
5)稀硫酸储罐中的硫酸浓度自动分析仪可以对稀硫酸的浓度进行测定并将测定结果通过信号输出到自动调节器,自动调节器对浓硫酸自动调节阀或水自动调节阀进行开启或关闭,实现稀释过程的连续生 产以及自动控制、调节。
【理化性质】[3]
1)与指示剂反应。稀硫酸能使酚酞试液不变色,使紫色石磊试液变红色。注意:是酸使指示剂显示不同的颜色。
2)与金属反应:


条件:金属活动顺序表中H 前面的金属。
例 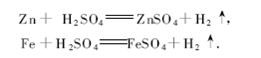
反应类型:置换反应。在此反应中,浓硫酸只表现了酸的氧化性,此氧化性较弱,只能把单质铁氧化成+2 价的Fe2 +。
3)与碱性氧化物反应
例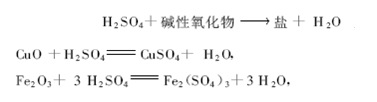
反应类型:复分解反应(反应前后化合价没有改变)。
4)与碱反应,酸碱的中和反应
例 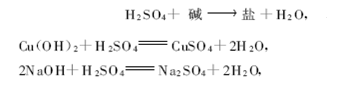
反应类型:复分解反应(反应前后化合价没有改变)。
5)与某些盐反应。
例 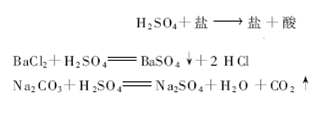
【特性】[3]
1. 浓硫酸的吸水性和脱水性
浓硫酸的吸水作用指的是,浓硫酸分子跟水分子强烈结合,生成一系列的水合物,如H2SO4 · H2O(SO3 ·2H2O),H 2SO4 · 2H 2O(SO3· 3H2O)和H2 SO4 · 4H2O(SO3 · 5H2O)。这些水合物很稳定,所以浓硫酸是很好的干燥剂。它不但能吸收空气中的水分,还能夺取结晶水合物中的结晶水。浓硫酸跟水生成水合分子的同时,会放出大量的热。浓硫酸可将许多有机化合物(尤其是糖类如纤维素、蔗糖等)脱水。反应时,按水分子中氢、氧原子数的比(2∶1)夺取这些有机物分子里的氢原子和氧原子。例如,浓硫酸跟蔗糖混合时,主要起脱水作用,同时浓硫酸又使游离出来的碳氧化而生成二氧化碳,它自身还原而生成二氧化硫, 反应时放出的热使水分蒸发。这些作用使有机物脱水后生成的碳的体积膨胀, 并呈疏松多孔状。但是,浓硫酸使有机物脱水时,并不一定都有碳游离出来。例如, 用甲酸制取一氧化碳或用酒精制取乙烯时,虽然都用浓硫酸作脱水剂,但没有碳游离出来。
2. 浓硫酸的氧化性
1)浓硫酸的氧化性和稀硫酸的氧化性的区别,稀硫酸的氧化性, 表现为酸的通性,即酸的氧化性,酸中的H+。而浓硫酸的氧化性,是浓H2SO4 中硫元素的化合价从+6 价降低到+4 价,从而表现浓H2SO4 的氧化性。
2)几个具体的化学反应
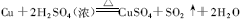
在此反应中,1 mol 的铜与2 mol 的浓H2 SO4 发生了反应。在2 mol 的浓H2 SO4 中,其中1 mol 的硫酸中S 元素的化合价没有改变,而另外的1 mol 的硫酸,S的化合价发生了改变,从+6 价降低到+4 价。由此可见,浓硫酸在此反应中,既表现了氧化性,又表现了酸性,即2 mol 的H2SO4 中,1 mol 的硫酸作氧化剂,另1 mol 的硫酸作酸。在此反应中 随着反应的进行,硫酸的量会逐渐减少,浓硫酸会变成稀硫酸,反应会逐渐停止。换句话说,在反应中生成1 mo l 的SO2,实际消耗的浓硫酸不止2 mol,肯定比2 mol 要多些。

在此反应中,1 mo l 的碳与2 mol 的浓硫酸发生了反应。在2 mol 的硫酸中,化合价均发生了改变, 硫元素从+6 价降低到+4 价。所以在此反应中,2 mol 的浓硫酸均作氧化剂。总之,硫酸在反应过程中,到底显示什么性质,显示酸性、吸水性或脱水性,还是显示酸的氧化性或氧化性酸, 要根据具体的反应来进行分析。
【应用】
浓硫酸因具有一定的脱水性,因此可用作干燥剂,化学上也可用作反应溶剂等,同时广泛应用于化工等领域。
【主要参考资料】
[1] 章艺;薛平正;王永芳;金显旺;傅士盛.一种浓硫酸连续自动稀释装置及稀释方法. CN201310092943.7,日2013-03-21
[2] 夏宪章. 一种浓硫酸稀释方法. CN101259955,申请日2007-3-6.
[3] 唐远志. 关于硫酸性质的教学[J]. 凯里学院学报, 2007, 25(3): 106-107.(四(三苯基膦)钯)
