成年个体脊髓损伤后的轴突再生修复是世界及医学难题。现有研究表明,CNS(中枢神经系统)轴突再生失败主要是由于抑制轴突再生的细胞外因子[1, 2]和神经内生性再生调控程序下调所导致[3, 4]。那么如何促进轴突损伤后的再生呢?
近日,德国Frank Bradke教授和他的团队给出了一个新的策略——肌动蛋白解聚因子(Actin Depolymerizing Factor,ADF)/丝切蛋白(AC)调控的肌动蛋白变化可促进成年人CNS轴突再生。存在证据表明,生长过程中,通过定向肌动蛋白逆流,ADF/AC家族可增强生长锥(Growth Cone,GC)动态性及促进神经伸长[5, 6]。AC蛋白与老化的肌动蛋白丝结合,通过切割和解聚功能使肌动蛋白丝变短[7, 8]。AC蛋白或许是CNS轴突再生的关键。
过往研究发现,若神经其外周轴突先于中枢轴突损伤,则损伤的中枢轴突会出现再生,此现象被称为“条件性处理”(Conditioning)[9-11]。结果表明,条件性处理通过增强AC蛋白的切割功能增强肌动蛋白的动态性,而这对轴突再生是十分必要的。
在该研究中发现,conditioned组(实验组)的生长锥肌动蛋白逆流成倍增加。前面提到AC蛋白通过肌动蛋白逆流来促进轴突再生。为明确这对于conditioning后的轴突生长是否必要,研究者应用了一种F肌动蛋白稳定剂Jasp,这可以降低其动态性[6]。结果表明肌动蛋白动态性增加确实是conditioning后轴突再生所必需的。
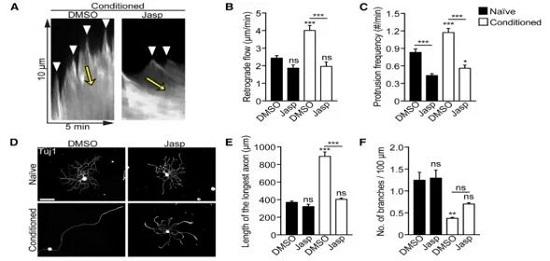
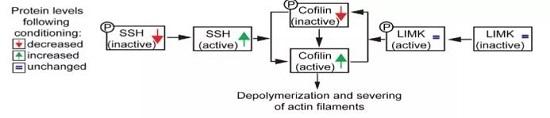
那么,肌动蛋白动态性受什么影响呢?在后续研究中发现,AC蛋白家族成员cofilin1,cofilin2和ADF的水平在conditioning后都未改变,但cofilin磷酸酶SSH1磷酸化的量变少了,表明SSH1活性增加[12],而上游使cofilin磷酸化和失活的激酶LIMK[13]水平未变。于是,周围神经损伤后cofilin活化,且有可能参与conditioning调控的轴突再生。
接下来研究者想通过敲除AC基因或转导cofilin等位基因变异体来探究AC蛋白的生理学作用。结果表明,单个基因敲除不影响conditioned后的轴突再生,于是进行了配对敲除和全敲除。结果显示在细胞培养下,敲除ADF和cofilin1(AC1 KO)仅中度减弱轴突生长和肌动蛋白动态性;敲除ADF和cofilin2(AC2 KO),cofilin1和cofilin2(C1C2 KO)皆是中度减弱轴突生长;三者敲除(AC1C2 KO)则显著影响轴突再生和降低肌动蛋白动态性。
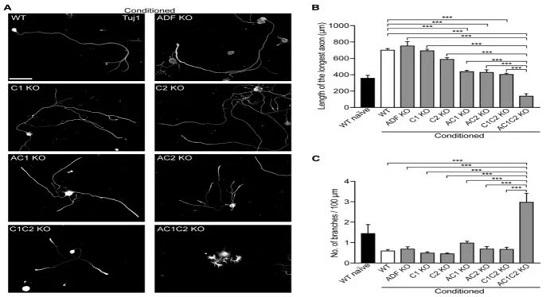
与预期一致的是,AC蛋白同样影响活体中枢神经损伤后的轴突再生。
在明确AC确实是损伤后轴突再生的关键后,研究者进一步探究到底是它的什么功能在影响再生,于是研究者在细胞培养的AC1C2 KO神经中表达cofilin1的变异体cofilin1(S94D)、cofilin1(Y82F)。前者只能解聚但不能切割,后者只能切割不能解聚[14, 15]。研究结果表明cofilin的切割功能对于轴突再生是十分必要的。
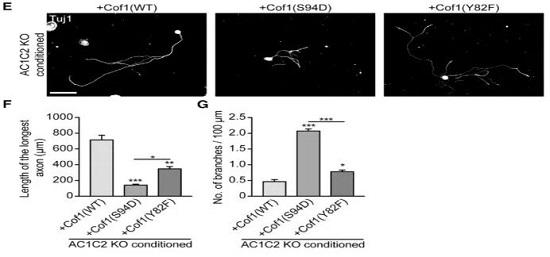
最后排除了conditioning的影响,仅过表达cofilin1(WT)。结果显示在无 conditioning影响下,过表达cofilin1(WT)可促进中枢损伤后轴突再生。研究者同时也分别过表达cofilin1(Y82F)和cofilin1(S94D),发现仅前者能起到促进轴突再生的作用。
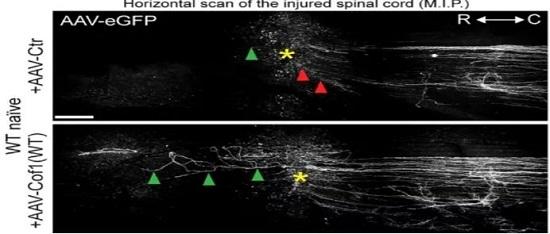
脊髓损伤后如何有效的促进轴突再生一直是一个难题,本篇文献从调节肌动蛋白活动这个方向切入,指出了肌动蛋白动态性的变化是影响轴突再生的关键步骤,深入探究了调控肌动蛋白动态性的分子机制,得出了AC蛋白成员cofilin1的切割功能是关键。或许,这篇文献能够给人以新的启发,从调控cofilin1来促进损伤后轴突的再生。
Reference:
1. Silver, D.J. and J. Silver, Contributions of chondroitin sulfate proteoglycans to neurodevelopment, injury, and cancer. Curr. Opin. Neurobiol., 2014. 27: p. 171-8.
2. Schwab, M.E. and S.M. Strittmatter, Nogo limits neural plasticity and recovery from injury. Curr. Opin. Neurobiol., 2014. 27: p. 53-60.
3. Tedeschi, A. and F. Bradke, Spatial and temporal arrangement of neuronal intrinsic and extrinsic mechanisms controlling axon regeneration. Curr. Opin. Neurobiol., 2017. 42: p. 118-127.
4. He, Z. and Y. Jin, Intrinsic Control of Axon Regeneration. Neuron, 2016. 90(3): p. 437-51.
5. Endo, M., et al., Control of growth cone motility and morphology by LIM kinase and Slingshot via phosphorylation and dephosphorylation of cofilin. J. Neurosci., 2003. 23(7): p. 2527-37.
6. Flynn, K.C., et al., ADF/cofilin-mediated actin retrograde flow directs neurite formation in the developing brain. Neuron, 2012. 76(6): p. 1091-107.
7. Bamburg, J.R. and O.P. Wiggan, ADF/cofilin and actin dynamics in disease. Trends Cell Biol., 2002. 12(12): p. 598-605.
8. Pollard, T.D., L. Blanchoin, and R.D. Mullins, Molecular mechanisms controlling actin filament dynamics in nonmuscle cells. Annu Rev Biophys Biomol Struct, 2000. 29: p. 545-76.
9. Tedeschi, A., et al., The Calcium Channel Subunit Alpha2delta2 Suppresses Axon Regeneration in the Adult CNS. Neuron, 2016. 92(2): p. 419-434.
10. Neumann, S. and C.J. Woolf, Regeneration of dorsal column fibers into and beyond the lesion site following adult spinal cord injury. Neuron, 1999. 23(1): p. 83-91.
11. Richardson, P.M. and V.M. Issa, Peripheral injury enhances central regeneration of primary sensory neurones. Nature. 309(5971): p. 791-3.
12. Eiseler, T., et al., Protein kinase D1 regulates cofilin-mediated F-actin reorganization and cell motility through slingshot. Nat. Cell Biol., 2009. 11(5): p. 545-56.
13. Arber, S., et al., Regulation of actin dynamics through phosphorylation of cofilin by LIM-kinase. Nature, 1998. 393(6687): p. 805-9.
14. Moriyama, K. and I. Yahara, The actin-severing activity of cofilin is exerted by the interplay of three distinct sites on cofilin and essential for cell viability. Biochem. J., 2002. 365(Pt 1): p. 147-55.
15. Moriyama, K. and I. Yahara, Two activities of cofilin, severing and accelerating directional depolymerization of actin filaments, are affected differentially by mutations around the actin-binding helix. Embo j., 1999. 18(23): p. 6752-61.
