基本描述
4-溴-1H-咪唑的CAS号是2302-25-2分子式是C3H3BrN2,分子量为146.97。熔点是131-135°C(lit.),沸点是324.7±15.0°C(Predicted),密度是1.904±0.06g/cm3,酸度系数(pKa)是11.70±0.10(Predicted),一般被储存在2-8°C下。
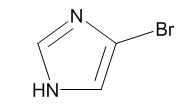
图1 4-溴-1H-咪唑的结构式。
合成

图2 4-溴-1H-咪唑的合成路线[1-3]。
方法一:
步骤1:在室温下向咪唑(60克,0.88摩尔)在氯仿(360毫升)中的溶液中滴加溴(138克,1摩尔)在氯仿(100毫升)中。然后将混合物搅拌1小时。除去溶剂后,将残余物悬浮于热水中,过滤并真空干燥以提供所需产物。64g白色固体。GC-MS:304(M+)。
步骤2:将2,4,5-三溴-1H-咪唑(32克,0.105摩尔)与20%亚硫酸钠水溶液(66.34克,0.527摩尔)回流8小时。冷却后沉淀固体产物,并通过真空过滤收集,得到所需产物4-溴-1H-咪唑。12.5g LC-MS:147.149(M+H+)。反应路线如图2所示。
方法二:
在30分钟内,将Br2(4.6 mL,90 mmol)在乙酸(10 mL)中的溶液添加到咪唑(2 g,30 mmol)和乙酸钠(22 g)在50 mL冰乙酸中的溶液中。在室温下搅拌反应混合物2小时。将反应混合物倒入50ml冰水中。过滤所得沉淀物。用水洗涤残留物,得到4-溴-1H-咪唑。反应路线如图2所示。
方法三:
在1.5小时内,将1-溴吡咯烷-2,5-二酮(11.50克,64.6毫摩尔)在DMF(100毫升)中的溶液添加到1H咪唑(4克,58.8毫摩尔)的DMF(100mL)溶液中。将反应混合物保持110小时。将反应混合物浓缩至干。将获得的残留物置于20%亚硫酸钠水溶液中。将残余物回流8小时并冷却。过滤沉淀并干燥以获得4-溴-1H-咪唑。反应路线如图2所示。
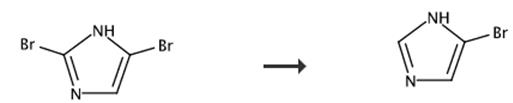
图3 4-溴-1H-咪唑的合成路线[4]。
将2,4-二溴-1H-咪唑(113毫克)、无水亚硫酸钠(252毫克、2.0毫摩尔、4.0当量)和软化水(2.5毫升)装入装有磁力搅拌棒的10毫升反应容器中密封容器。在CEM discover SP微波合成器中以高搅拌速度预混合反应混合物一分钟。用微波反应器以功率150W照射反应混合物,同时用压缩空气(24psi)冷却。当达到所需温度(100°C)时,自动调整功率,以保持设定的反应温度1小时。用压缩空气将容器冷却至约40°C(冷却时间1∼ 分钟)。将反应混合物提取至EtOAc(3×5ml)。在无水MgSO4上干燥反应混合物。减压蒸发溶剂得到4-溴-1H-咪唑。
应用
4-溴-1H-咪唑是一种含有两个N原子的五元杂环化合物,其中的咪唑环是生物体内RNA和DNA嘌呤的组分[5]。咪唑环是一种缺电子环,具有非中心对称结构,广泛存在于生物分子中。4-溴-1H-咪唑及其衍生物是一类新型的有效的双光子吸收化合物[6]。其中,具有D-π-A 结构的咪唑有较大的双光子吸收截面和较高的荧光量子产率,有双光子诱导蓝光发射的光学特性,成为双光子荧光显微与成像的较好候选材料。许多此类咪唑衍生物还广泛应用于精细化工、离子液体等领域。
4-溴-1H-咪唑具有良好的生理活性,如作为大部分天然酶的活性中心功能基,能够参与许多重要的生物化学反应,因而被誉为“生物催化剂”或“生物配体”。同时它们还具有抗肿瘤、消炎、降血压等药理活性,如某些芳基咪唑衍生物还用作胰高血糖素受体的拮抗剂、5-脂肪氧合酶和L-1生物合成的抑制剂[7-9]。近年来,因其在医药和农药领域的重要作用,咪唑-4-甲酸甲酯已经引起了国内外化学家对新型含氮杂环化合物合成及应用的热点研究。4-溴-1H-咪唑分子具有易功能化和良好的电子转移性等优点[10]。最近,化学家们发现4-溴-1H-咪唑是一类十分重要的有机功能材料,其在有机光电、制药、化学发光等领域有着广泛的应用。
参考文献
[1] R. Amaradhi, S. Mohammed, A. Banik, R. Franklin, R. Dingledine, T. Ganesh, Second-Generation Prostaglandin Receptor EP2 Antagonist, TG8-260, with High Potency, Selectivity, Oral Bioavailability, and Anti-Inflammatory Properties, ACS Pharmacol. Transl. Sci. 5(2) (2022) 118-133.
[2] A.C. Castro, M. Burke, Preparation of heterocyclic compounds as TEAD degraders and uses thereof, Ikena Oncology, Inc., USA . 2022, p. 570pp.
[3] A.C. Castro, M. Burke, Preparation of heterocycles as TEAD inhibitors and uses thereof, Ikena Oncology, Inc., USA . 2022, p. 325pp.
[4] A.C. Castro, M. Burke, B. Amidon, H. Frosch, Combination of a 3-(imidazol-4-yl)-4-(amino)-benzenesulfonamide TEAD inhibitor with an EGFR inhibitor and/or MEK inhibitor for use in the treatment of lung cancer, Ikena Oncology, Inc., USA . 2022, p. 412pp.
[5] D.J. Hardick, W.P. Blackaby, E.J. Thomas, F.A. Brookfield, J. Shepherd, C. Bubert, M.P. Ridgill, Preparation of heteroaromatic compounds as METTL3 inhibitory compounds, Storm Therapeutics Limited, UK . 2022, p. 318pp.
[6] W.M. Jones, A.D. Lebsack, R.L. Wolin, A.R. Rovira, Small molecules as inhibitors of NF-κB inducing kinase and their preparation, Janssen Pharmaceutica NV, Belg. . 2022, p. 391pp.
[7] J.K. Lee, J. Min, J.K. In, Y.H. Kim, B. Jeon, Y. Han, H.J. Yoon, H.M. Kim, Oxadiazole triazole derivatives as histone deacetylase 6 inhibitor, and pharmaceutical composition comprising the same, Chong Kun Dang Pharmaceutical Corp., S. Korea . 2022, p. 584pp.
[8] D. McMinn, M. Rao, Preparation of functionalized thiazoles as protein secretion inhibitors, Kezar Life Sciences, USA . 2022, p. 210pp.
[9] L.Q. Setti, S. Nilar, Z. Li, M. Yu, M. Zancanella, Preparation of sulfonyl pyrrolo[3,4-c]pyrazole derivatives and uses thereof, Global Blood Therapeutics, Inc., USA . 2022, p. 235pp.
[10] K. Vandyck, P.J.-M.B. Raboisson, L. Beigelman, V. Serebryany, A.D. Stoycheva, D.A.M.-E. Bardiot, S. Boland, A.D.M. Marchand, Preparation of heteroaryl compounds as anti-viral agents for treatment of coronavirus, picornavirus, and norovirus infection, Aligos Therapeutics, Inc., USA; Katholieke Universiteit Leuven . 2021, p. 554pp.
