概述[1]
硫化亚铁系黑棕色六方晶系结晶,几乎不溶于水、不溶于氨和酸反应生成亚铁盐和硫化氢气体。在潮湿空气中逐渐氧化而分解成硫和四氧化三铁,并放热。硫化亚铁的制备方法有多种,常用的有两种:一种是直接加热法,一种是液相反应法。
性能[2]
1)FeS的摩擦性能
FeS作为一种固体润滑介质,它在摩擦副间隔绝金属的直接接触,且和基体材料的结合力较弱,剪切强度较低。FeS具有层状的六方结构,它本身易于沿底面滑移进行塑性变形,而且硫化物层可沿摩擦方向转动配列。硫化物中的高空位浓度有利于氧的扩散和氧化膜的形成,从而对避免胶合、粘着和提高边界润滑金属的耐磨性有利。同时硫化物层呈疏松多孔的磷片状组织,有利于存贮润滑油,因此无论在干摩擦或油润滑条件下,均具有良好的减摩抗咬合作用。基体的硬度也会对F eS的摩擦性能产生影响,其原因在于较低的硬度不足以抵抗对摩件坚硬的微凸体对基体的犁削破坏,使得渗硫层失去支撑,被碾压剥落,从而丧失固体润滑作用。
2)FeS的氧化性
干燥的硫化亚铁在空气中,即使是在空气湿度很大的情况下,其氧化速度也非常缓慢;若在FeS试样中加入少量的水,放置于空气中,经过一段时间,则表面会发生明显的化学反应,在这一过程中硫化亚铁子开始与吸附的氧气发生氧化反应,但此时硫化亚铁分子氧化速度比较慢。随着反应的进行,由于能量的聚集,温度开始升高,此时反应速率常数增大,硫化亚铁氧化反应速度也随着增加;但如果有油包裹在硫化亚铁的表面时,硫化亚铁的氧化速度会大大降低,这是由于在有少许油品存在时,油膜包裹在硫化亚铁颗粒的表面上,阻止了氧气分子与硫化亚铁的充分接触,氧气分子不易接触到硫化亚铁颗粒,很难吸附在硫化亚铁的表面上,从而抑制了硫化亚铁的氧化反应。
应用[2]
1)FeS作为固体润滑剂
目前已生产的具有FeS表面的零件主要有:滚动轴承;多种轴活塞、缸套;大马力柴油机变速器齿轮等多种齿轮;铣刀、插齿刀、钻头、丝锥;冷冲模;工业缝纫机中多种运动件;柴油机柱塞偶件等等。使用寿命一般能延长1 ~ 10倍。无论干摩擦或油润滑、滚动或滑动以至切削,具有FeS表面润滑材料的零件均具有良好润滑和减少摩擦磨损的效果,还能提高整机的机械效率。
2)FeS作为电极
有人将利用高温合成方法制备出的硫化亚铁应用于电极上,表明硫化亚铁电极具有理想的充放电性能。集流体是硫化亚铁阴极的关键部件之一,如果用泡沫镍等集流体,可首先用电镀方法在镍集流体上沉积一层铁,然后在熔盐体系中电化学合成硫化亚铁阴极。泡沫镍的孔隙、镀铁层的厚度、硫化亚铁膜层的厚度和孔隙率大小等因素对电池性能有一定的影响。
3)FeS在处理含铬污水中的应用
用FeS处理含C r (VI) 废水是近年来新提出的一种处理方法。这种方法具有效果好、方法简便且还原剂来源广、价格低等优点。硫化亚铁在处理铬污水时主要是起还原剂的作用,本身被氧化,相应铬(VI) 则被还原成低毒性的铬(Ⅲ )。总的反应式可用如下方程式表示:
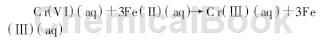
实际反应过程较上式复杂,三价铁与铬(VI)混在一起形成新的化合物,按照浓度不同组成比例有差异。这些反应速度都很快,通常10 m in以内就能有90%以上的除铬(VI) 效果,在偏酸性条件下效果比较好且速度快。
制备[2]
1.微乳液法
1943年首次报道了一种分散体系:水和油与大量的表面活性剂和助表面活性剂混合能自发地形成透明或半透明的体系。这种体系经确证也是一种分散体系,可以是油分散在水中(O W/型),也可以是水分散在油中(W /O型)。分散相质点为球形,但半径非常小,通常为10 ~ 100 nm 范围,是热力学稳定体系。在相当长的时间内,这种体系分别被称为亲水的油胶团(HydrophilcO leom icelles) 或亲油的水胶团(O leophilic Hydrom icelles),亦称为溶胀的胶团或增溶的胶团。直到1959年Schu lman等才首次将上述体系称为“微乳状液” 或“微乳液”(M icroem ulsion),于是“微乳液” 一词正式诞生。
微乳液是2种不互溶液体形成的热力学稳定的、各向同性的、外观透明或半透明的分散体系,微观上由表面活性剂界面膜稳定的1种或2种液体的微滴所构成,一般地,可将其分为O W/ 型和W /O型。用来制备纳米材料的微乳液往往是W /O 型体系,常由4个组分构成:表面活性剂、助表面活性剂、有机溶剂和水溶液,有些体系中可以不加助表面活性剂。微乳液法的特点在于:粒子表面包裹了一层表面活性剂分子,使粒子间不易聚结;通过选择不同的表面活性剂分子可对粒子表面进行修饰,并控制微粒的大小。用微乳方法制备颗粒,技术关键有以下几点:(1) 选择一个适当的微乳体系; (2) 选择适当的沉淀条件以获得分散性好,粒度均匀的超细颗粒;(3)选择适当的后处理条件以保证超细粒子聚集体的均匀性。通过选择合适的微乳液体系,使用氯化亚铁和硫化钠可制备出圆球状的FeS粒子。
2)均相沉淀法
一般的沉淀过程是不平衡的,但如果控制溶液中的沉淀剂浓度,使之缓慢地增加,控制过饱和度在适当的范围内,则溶液中的沉淀可处于平衡状态,避免浓度不均匀现象,从而控制颗粒生长速度,沉淀能在整个溶液中均匀出现,获得纯度高、粒度均匀的纳米颗粒,这种方法称为均相沉淀法。通常,溶液中的化学反应是沉淀剂缓慢地生成,克服了由外界向溶液中加沉淀造成沉淀剂的局部不均匀性,使沉淀剂不能在整个溶液中均匀反应的缺点。通过均相沉淀法,以硫代乙酰胺(TAA) 和硫酸亚铁铵(A ISH ) 为主要原料可以成功地合成FeS粉末。
3)辉光放电合成FeS
以硫的蒸气进行气体放电,在160 ~ 180 ℃的温度和真空反应室中(有阴极和阳极),当反应室中充满硫蒸气时,在阴极和阳极间施以高压直流电时,即产生辉光放电,硫离子与阴极盘上的工件产生物理化学作用与零件表面的元素化合,而成硫化物层。在100 ~ 300 ℃温度下,能获得100 ~ 120 μm的FeS层。
4)离子渗硫
离子渗硫FeS层是在低温离子渗硫炉内190 ℃温度条件下渗硫处理3 h所得。反应气体为固体硫蒸气。工件接阴极,炉壁接阳极,达到一定的真空度时,阴阳极间加高压直流电,固体硫蒸发。硫蒸气在直流高压电场作用下被加速冲向工件表面,使表面产生大量晶体缺陷,硫原子沿着晶界和缺陷向内扩渗,与Fe原子作用生成FeS。
5)高温合成法
采用光谱纯的Fe 和S为原料,将Fe 车削成铁屑,采用氢气高温还原装置将铁屑进行还原处理。按化学计量称取Fe和S,封装于充有高纯氩气的石英管中,置于立式高温炉内。参考Fe-S 二元系相图,反应温度为400 ~ 1 200 ℃。冷却后,将样品研磨成粉末,装入石英管后,充入高纯氩气后封装。
主要参考资料
[1] 高纯度硫化亚铁的制备
[2] 硫化亚铁的产生及自燃预防
[3] FeS材料的制备、性能与应用
