背景[1-6]
SimplyBlue SafeStain是一种即用型的快速、灵敏且安全的Coomassie®G-250染料(Coomassie®G-250 stain),用于对聚丙烯酰胺凝胶分离的蛋白质条带进行染色。该染料消除了制备染色溶液所需的大量时间和成本。
与传统R-250和某些G-250 Coomassie®染料(G-250 Coomassie®stain)不同的是,SimplyBlue™SafeStain对人体完全无害,并且无需甲醇或乙酸固定剂或脱色剂。避免了接触有毒物质和难闻气味的风险,创造更健康的实验室环境。
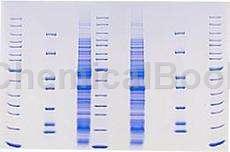
操作步骤[1-6]
SimplyBlue SafeStain一般用于1.0毫米和1.5毫米Tris-甘氨酸凝胶,1.0毫米Tricine,酶谱和IEF迷你凝胶(8 x 8厘米)。电泳后,请按照以下说明操作。确保迷你凝胶在水中或污渍中自由移动,以便在所有步骤中扩散。用100ml去离子水冲洗微型凝胶3次,每次5分钟,以除去SDS和缓冲盐,这会干扰染料与蛋白质的结合。丢弃每次冲洗。用足够的SimplyBlue™SafeStain(20-100 ml)染色迷你凝胶以覆盖凝胶。在室温下轻轻摇动1小时。
将在几分钟内开始发展。孵育后,丢弃污渍。污渍不能重复使用。注意:凝胶可以染色长达3小时,但3小时后,敏感度会降低。如果您需要将凝胶在污渍中过夜,每20毫升污渍中加入2毫升20%NaCl(w/v)水溶液。此过程不会影响灵敏度。用100毫升水洗涤微型凝胶1-3小时。凝胶可以在水中放置数天而不会损失灵敏度。水中有少量染料与结合在蛋白质上的染料达到平衡,因此蛋白质将保持蓝色。为了获得最清晰的摄影背景,用100毫升水进行第二次1小时的洗涤。
注意:如果凝胶在水中停留超过1天,灵敏度现在会降低。减少水中的游离染料有利于染料从蛋白质中解离。如果您需要将凝胶在水中存放几天,请加入20毫升20%NaCl。
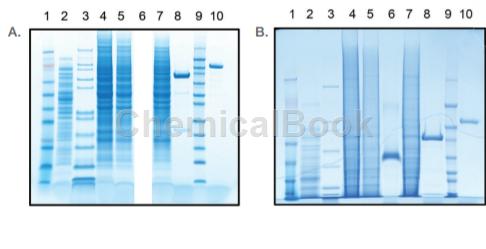
应用[7][8]
用于蜱唾液腺蛋白Salp20的补体抑制机制和卵黄发生的激素调控研究中WB实验中的蛋白染色。
蜱唾液腺蛋白Salp20能保护莱姆病血清敏感型病原体伽氏疏螺旋体(B.garinii)免受补体介导的裂解。本文表达纯化了蜱唾液腺蛋白Salp20,对其分离纯化条件进行了优化,并对其补体抑制机制进行了研究。该研究对蜱媒疾病防治和畜牧业发展具有重要的理论和实际应用意义。优化后的分离条件为:500ml样品量流经500μl的Ni-NTA亲和层析柱,用2ml含有20mM咪唑的缓冲液清洗四次,用250μl含有500mM咪唑的洗脱液洗脱四次并收集样品。SDS-PAGE和Western blot分析所得蛋白样品,结果显示蛋白具有高纯度且为目的蛋白Salp20。纯化的Salp20能够保护伽氏疏螺旋体免受补体裂解,证明分离纯化所得蛋白具有很高的生物学活性。用C3b单克隆抗体检测莱姆病病原体表面C3b的沉积,免疫荧光分析结果显示血清敏感型病原体伽氏疏螺旋体表面有大量的C3b沉积,而血清抗型伯格多弗疏螺旋体表面C3b沉积量极少。
说明血清敏感型病原体伽氏疏螺旋体能够引发强烈的补体反应,而血清抗型伯格多弗疏螺旋体不能。用C3b和P因子单克隆抗体检测伽氏疏螺旋体表面补体替代途径中C3b和P因子的沉积,免疫荧光分析结果显示菌体表面有大量的C3b和P因子沉积,说明伽氏疏螺旋体引发了强烈的补体替代途径反应。向反应体系加入10μg/ml Salp20后,菌体表面没有C3b和P因子沉积,说明Salp20可抑制补体替代途径中的C3b和P因子结合到伽氏疏螺旋体表面。伽氏疏螺旋体与10μg/ml P因子反应后,菌体表面无P因子的沉积。伽氏疏螺旋体与C3缺失型人血清反应后,发现菌体表面无P因子。表明P因子不能直接与伽氏疏螺旋体表面结合来起始补体替代途径。
因此Salp20通过P因子结合,使其不能稳定C3转化酶,抑制了C3b蛋白的产生,从而抑制了补体替代途径。研究了两种激素20-羟基蜕皮酮(20-hydroxyecdysone,20E)和保幼激素III(juvenile hormone III,JH III)对长角血蜱(Haemaphysalis longicornis)孤雌生殖种群卵黄发生的影响,对揭示蜱类生殖生物学规律和蜱类防治具有重要的科学意义。
参考文献
[1]Morphological,biological and molecular characteristics of bisexual and parthenogenetic Haemaphysalis longicornis[J].Ze Chen,Xiaojun Yang,Fengju Bu,Xiaohong Yang,Jingze Liu.Veterinary Parasitology.2012(2-4)
[2]A Tick Mannose-Binding Lectin Inhibitor Interferes with the Vertebrate Complement Cascade to Enhance Transmission of the Lyme Disease Agent[J].Tim J.Schuijt,Jeroen Coumou,Sukanya Narasimhan,Jianfeng Dai,Kathleen DePonte,Diana Wouters,Mieke Brouwer,Anneke Oei,Joris J.T.H.Roelofs,Alje P.van Dam,Tom van der Poll,Cornelis van’t Veer,Joppe W.Hovius,Erol Fikrig.Cell Host&Microbe.2011(2)
[3]Effect of 20-hydroxyecdysone and haemolymph on oogenesis in the ixodid tick Amblyomma hebraeum[J].Adriana Seixas,Kevin J.Friesen,W.Reuben Kaufman.Journal of Insect Physiology.2008(7)
[4]Cloning and characterization of a cDNA clone encoding calreticulin from Haemaphysalis qinghaiensis(Acari:Ixodidae)[J].Jinliang Gao,Jianxun Luo,Ruiquan Fan,Volker Fingerle,Guiquan Guan,Zhijie Liu,Youquan Li,Haiping Zhao,Miling Ma,Junlong Liu,Aihong Liu,Qiaoyun Ren,Zhisheng Dang,Chihiro Sugimoto,Hong Yin.Parasitology Research.2008(4)
[5]The Structure of OMCI,a Novel Lipocalin Inhibitor of the Complement System[J].Pietro Roversi,Olga Lissina,Steven Johnson,Nurfilza Ahmat,Guido C.Paesen,Kerstin Ploss,Wilhelm Boland,Miles A.Nunn,Susan M.Lea.Journal of Molecular Biology.2007(3)
[6]Differential anti‐chemokine activity of Amblyomma variegatum adult ticks during blood‐feeding[J].Parasite Immunology.2007(4)
[7]Boophilus microplus:Its saliva contains microphilin,a small thrombin inhibitor[J].Alessandra Ciprandi,Simone Kobe de Oliveira,Aoi Masuda,Fabiana Horn,Carlos Termignoni.Experimental Parasitology.2006(1)
[8]杨晓红.蜱唾液腺蛋白Salp20的补体抑制机制和卵黄发生的激素调控[D].河北师范大学,2013.
