背景[1-6]
Y187感受态细胞是实验室常用酵母双杂用菌株,MATα型,可转化质粒或mating操作,Transformationmarker为:trp1,leu2,报告基因为:lacZ,MEL1,经PGADT7质粒检测转化效率为104cfu/μgDNA。Y187-GAL4酵母双杂系统需要两种质粒配套使用:pGBKT7和pGADT7。质粒pGBKT7的筛选标志为TRP1,用于表达DNA-BD(来自酵母转录因子GAL4N端1~174位氨基酸)与目标蛋白(Bait)的融合蛋白;质粒pGADT7的筛选标志为LEU,用于表达AD(GAL4 C端768~881位氨基酸)与目标蛋白(Prey)的融合蛋白。
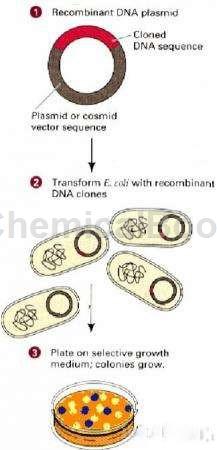
GAL4系统原理:一个完整的酵母转录因子GAL4可分为功能上相互独立的两个结构域:位于N端1~174位氨基酸区段的DNA结合域(DNA-BD)和位于C端768~881位氨基酸区段的转录激活域(AD)。
DNA-BD能够识别GAL4-responsive gene的上游激活序列UAS,并与之结合。而AD可以启动UAS下游的基因进行转录。BD和AD单独存在不能激活转录,但当二者接近时,则呈现完整的GAL4活性,使含有UAS的启动子下游基因转录表达。正常条件下,BD不与AD结合,将要检测的蛋白质分别与BD和AD融合,形成bait融合蛋白(bait–BD)和prey融合蛋白(prey-AD),如果bait和prey发生相互作用,就会促使BD和AD的相互接近,形成完整的GAL4,从而激活报告基因的转录。Y187有两个报告基因:lacZ,MEL1,分别由两种不同的启动子(G1,M1)启动,这两种启动子只有GAL4识别的17 bp核心区相同,其余部分均不同,大大降低了酵母双杂假阳性发生的概率。
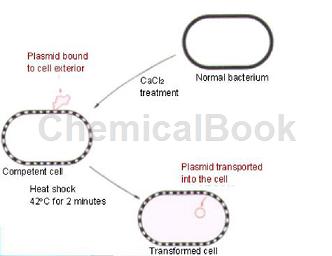
操作方法:
1.取100μl冰上融化的Y187感受态细胞,依次加入预冷的目的质粒2-5μg,Carrier DNA(95-100度5 min,快速冰浴,重复一次)10μl,PEG/LiAc 500μl并吸打几次混匀,30度水浴30 min(15 min时翻转6-8次混匀)。
2.将管放42℃水浴15 min(7.5 min时翻转6-8次混匀)。
3.5000 rpm离心40 s弃上清,ddH2O 400μl重悬,离心30s弃上清。
4.ddH2O 50μl重悬,涂板,29℃培养48-96 h。
注意事项:
1.感受态细胞在冰上融化。
2.转化高浓度的质粒可相应减少最终用于涂板的菌量。
3.同时转化2-3种质粒时可增加质粒的用量。
4.Y187酵母菌株对高温敏感,最适生长温度为27-30℃;高于31℃,生长速度和转化效率呈指数下降。
5.菌落变粉不是污染,是酵母细胞生长中一个常见现象。当细胞在平板培养几天后,平板上的Adenine被酵母消耗完毕,酵母试图通过自身代谢途径合成Adenine以供利用,然而,有些菌株的ADE2基因被破坏,Adenine合成途径受阻;又由于其ADE4,5,6,7,8基因均正常,所以造成中间产物P-ribosylamino imidazole(AIR)在细胞中积累而使菌落变为粉红色。
6.酵母在缺陷培养基中生长速度比YPDA培养基慢,培养基中缺陷成分越多,生长越慢,以转化涂板为例:涂YPDA平板29℃,48 h培养可见直径1 mm克隆;涂SD单缺平板29℃,48-60 h培养可见直径1 mm克隆,涂SD双缺平板29℃,60-80 h培养可见直径1 mm克隆,涂SD三缺或四缺平板平板29℃,80-90 h培养可见直径1 mm克隆。
应用[7][8]
Y187感受态细胞利用酵母双杂交鉴定芥菜开花调控蛋白FLC的同源互作研究:
芥菜(Brassica juncea Coss.)是十字花科芸薹属蔬菜作物,低温春化能诱导植株开花。FLOWERING LOCUS(FLC)是春化途径和自主途径的关键基因,能抑制植物开花。FLC属于MIKC型MADS盒转录调节蛋白,是决定植物开花信号整合子的核心转录因子之一,处于整个开花调控网络中的枢纽地位。它的高水平表达抑制了下游开花整合基因,对开花具有强抑制作用。
FLC主要在植物叶片和茎尖、根尖分生组织中广泛表达,其表达量多少与抑制开花作用强弱呈正相关。在叶片中,大量表达FLC可抑制至少两种系统信号的产生,从而推迟开花;在分生组织处,FLC通过直接抑制MADS盒转录因子SUPPRESSOR OF OVEREXPRESSION OF CONSTANS(SOC1)及调节bZIP转录因子FD的表达,进而降低对FT蛋白信号的应答。在FRIGIDA(FRI)依赖途径中,FRI可以促进FLC的表达进而延迟开花。
多个MADS盒转录因子往往能够相互作用形成蛋白复合体,从而参与植物生长发育的调控。在拟南芥(Arabidopsis thaliana)中,FLC能够和同样是开花抑制调节蛋白的SHORT VEGETATIVEPHASE(SVP)相互作用并形成蛋白复合体,而突变体svp则在很大程度上抑制了FLC的晚花表型。芥菜SVP与FLC能够在pET原核表达系统和酵母真核表达系统中相互作用,并可以形成稳定的异源蛋白复合物。
参考文献
[1]A MADS domain gene involved in the transition to flowering in Arabidopsis[J].The Plant Journal.2008(5)
[2]Does sequence polymorphism of FLC paralogues underlie flowering time QTL in Brassica oleracea?[J].H.Razi,E.C.Howell,H.J.Newbury,M.J.Kearsey.Theoretical and Applied Genetics.2008(2)
[3]The Arabidopsis thaliana AT PRP39-1 gene,encoding a tetratricopeptide repeat protein with similarity to the yeast pre-mRNA processing protein PRP39,affects flowering time[J].Cunxi Wang,Qing Tian,Zhenglin Hou,Mark Mucha,Milo Aukerman,Odd-Arne Olsen.Plant Cell Reports.2007(8)
[4]Mapping and characterization of FLC homologs and QTL analysis of flowering time in Brassica oleracea[J].K.Okazaki,K.Sakamoto,R.Kikuchi,A.Saito,E.Togashi,Y.Kuginuki,S.Matsumoto,M.Hirai.Theoretical and Applied Genetics.2007(4)
[5]Delayed flowering time in Arabidopsis and Brassica rapa by the overexpression of FLOWERING LOCUS C(FLC)homologs isolated from Chinese cabbage(Brassica rapa L.ssp.pekinensis)[J].Soo-Yun Kim,Beom-Seok Park,Soo-Jin Kwon,Jungsun Kim,Myung-Ho Lim,Young-Doo Park,Dool Yi Kim,Seok-Chul Suh,Yong-Moon Jin,Ji Hoon Ahn,Yeon-Hee Lee.Plant Cell Reports.2007(3)
[6]The Arabidopsis FLC protein interacts directly in vivo with SOC1 and FT chromatin and is part of a high‐molecular‐weight protein complex[J].Craig C.Wood,MasumiRobertson,W.James Peacock,Elizabeth S.Dennis.The Plant Journal.2006(2)
[7]Photoperiodic flowering of Arabidopsis:integrating genetic and physiological approaches to characterization of the floral stimulus[J].L.CORBESIER,G.COUPLAND.Plant,Cell&Environment.2004(1)
[8]丁宁.利用酵母双杂交鉴定芥菜开花调控蛋白FLC的同源互作研究[D].西南大学,2013.
