背景[1-5]
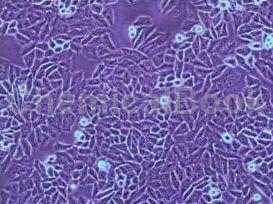
大鼠肾上皮细胞是通过酶解法从大鼠肾小管上皮组织中制的原代细胞,CK-18、CK-19呈阳性,细胞纯度可达90%以上,且不含有HIV-1、HBV、HCV、支原体、细菌、酵母和真菌等。肾小管上皮细胞对肾功能的发挥起着重要作用。它们几乎能重吸收肾小球滤过液中所有的葡萄糖和氨基酸,并使其它非营养物质排泄到尿液中。肾小管上皮细胞能产生包括细胞因子和趋化因子在内的炎性介质,并通过产生IL-8从而影响和指导白细胞的分化来积极参与急性炎症过程。在肾脏移植后或新月体肾炎的炎症过程中,肾小管上皮细胞表达IL-2α受体和II类MHC抗原,这表明它们参与肾脏免疫系统损伤的发病机理。
肾小管上皮细胞通过主动、被动以及吞饮(胞饮)的功能,对流经肾小管的原尿中的电解质(Na+、Cl-、K+、HCO3-)与葡萄糖、氨基酸以及水等物质起到重吸收作用。分泌K+、泌H+、泌NH3、碱性磷酸盐(NaHPO4)及排酸功能,排出酸性磷酸盐(NaH2PO4)。调节水、电解质平衡。肾小管上皮细胞,通过对HCO3-排出的多少来调节体内的酸碱平衡;当体内酸中毒时,则排出HCO3-减少,重吸收增多以补充血内碱储备,而当体内碱多时,则排出量增加以达体内酸碱动态平衡。
大鼠肾上皮细胞复苏:
1)从液氮中取出细胞冻存管(注意:佩戴防爆管面具),快速将其置入37℃水浴中解冻,直至冻存管中无结晶,然后用75%的酒精擦拭冻存管外壁;
2)将冻存管中的细胞移至15ml无菌离心管中,滴加入完全培养液5ml混匀细胞,然后将细胞悬液转移至适当面积大小的培养皿中;
3)放置于37℃,5%CO2细胞培养箱中培养;
4)第二天,换用新鲜完全培养基继续培养。
应用[6][7]
用于评估体外药物模型系统和调节特定基因的遗传功能。
在高钙对大鼠肾上皮细胞的损伤效应及骨桥蛋白表达的影响研究中观察高钙对大鼠肾上皮细胞(NRK细胞)的损伤效应以及对骨桥蛋白(OPN)表达的影响,探讨高钙尿在含钙肾结石形成中的作用和机制。分别用含钙终浓度为1mg/ml、2mg/ml和3mg/ml的DMEM完全培养基培养NRK细胞(实验组1,2,3),空白对照组采用DMEM完全培养基,共同培养3小时、6小时和24小时后,采用CCK-8法检测细胞增殖;细胞培养上清液应用ELISA法检测细胞OPN的分泌情况;收集细胞,应用流式细胞仪检测细胞凋亡率;应用real timeRT-PCR法和Western Blot法,检测细胞OPN基因mRNA及蛋白的表达情况。
结果:
(1)空白对照组、实验组1、实验组2和实验组3培养3小时的吸光度值(OD值)分别为3.147±0.060、2.844±0.309、2.321±0.089、19.893±0.611,6小时为3.472±0.097、2.878±0.127、2.545±0.06、2.222±0.047,24小时为3.851±0.096、1.831±0.076、0.669±0.093、0.569±0.004,除实验组1在3h较空白对照组差异无统计学意义(P>0.05)外,各实验组在不同时间点较对照组差异均有统计学意义(P<0.05)。各实验组内在不同时间点进行两两比较,除实验组1在3h和6h差异无统计学意义外,其他均有统计学意义(P<0.05)。
(2)各组细胞在培养3小时后的凋亡率分别为2.36%、3.07%、4.53%、5.40%,6小时后的凋亡率分别为2.36%、4.75%、7.28%、7.83%,24小时后的凋亡率分别为2.36%、41.76%、56.84%、62.96%。
(3)各组细胞培养3小时后上清液中OPN的含量(μg/ml)分别为10.461±1.573、14.820±1.213、17.150±0.841、19.893±0.611,6小时分别为10.461±1.573、23.791±1.518、26.307±0.876、28.607±0.733,24小时分别为10.461±1.573、26.882±1.100、28.948±1.818、24.377±0.641。三个时间点各实验组分别与空白对照组比较差异均有统计学意义(P<0.05)。同一实验组内在不同时间点进行两两比较,除实验组2在6h和24h差异无统计学意义(P>0.05)外,其余均有统计学意义(P<0.05)。高浓度钙可明显抑制NRK细胞增殖,诱导细胞凋亡,细胞OPN基因表达上调,细胞分泌OPN增加。推测高钙尿可能通过诱导肾小管上皮细胞损伤和OPN的表达上调,促进尿液晶体与肾小管上皮细胞发生黏附,从而在肾结石形成中产生一定的作用。
参考文献
[1]Knockdown of Osteopontin Reduces the Inflammatory Response and Subsequent Size of Postsurgical Adhesions in a Murine Model[J].Stuart Andrews,Debi Ford,Paul Martin.The American Journal of Pathology.2012(4)
[2]Mitochondrial permeability transition pore opening induces the initial process of renal calcium crystallization[J].Kazuhiro Niimi,Takahiro Yasui,Masahito Hirose,Shuzo Hamamoto,Yasunori Itoh,Atsushi Okada,Yasue Kubota,Yoshiyuki Kojima,Keiichi Tozawa,Shoichi Sasaki,Yutaro Hayashi,Kenjiro Kohri.Free Radical Biology and Medicine.2012(7)
[3]Role of osteopontin in early phase of renal crystal formation:immunohistochemical and microstructural comparisons with osteopontin knock-out mice[J].Masahito Hirose,Keiichi Tozawa,Atsushi Okada,Shuzo Hamamoto,Yuji Higashibata,Bin Gao,Yutaro Hayashi,Hideo Shimizu,Yasue Kubota,Takahiro Yasui,Kenjiro Kohri.Urological Research.2012(2)
[4]Estrogen Inhibits Vascular Calcification via Vascular RANKL System:Common Mechanism of Osteoporosis and Vascular Calcification[J].Mariana Kiomy Osako,Hironori Nakagami,Nobutaka Koibuchi,Hideo Shimizu,Futoshi Nakagami,Hiroshi Koriyama,Munehisa Shimamura,Takashi Miyake,Hiromi Rakugi,Ryuichi Morishita.Circulation Research.2010(4)
[5]Face-specific incorporation of osteopontin into urinary and inorganic calcium oxalate monohydrate and dihydrate crystals[J].Urological Research.2010(5)
[6]The impact of osteopontin promoter polymorphisms on the risk of calcium urolithiasis[J].Chia-Chu Liu,Shu-Pin Huang,Li-Yu Tsai,Wen-Jeng Wu,Suh-Hang Hank Juo,Yii-Her Chou,Chun-Hsiung Huang,Ming-Tsang Wu.Clinica Chimica Acta.2010(9)
[7]刘喆.高钙对大鼠肾上皮细胞的损伤效应及骨桥蛋白表达的影响[D].苏州大学,2013.
