二氧化锰为深棕色粉末,mp 535 oC (分解),d 5.03 g/cm3。不溶于水和有机溶剂。其可用作商品化试剂。
在有机合成中,MnO2 被用作氧化剂,其反应活性与其结构、制备方法以及溶剂极性有关[1]。以下是有二氧化锰参与氧化反应的一些实例。
一、不饱和脂肪醇的氧化
用MnO2能将烯丙基醇转化为α,β-乙烯基醛,当醇或胺存在时,酰基氰化物会醇解或氨解得到相应的α,β-乙烯基酯和氨。炔丙基醇可以被MnO2氧化成烷基醛和酮,而不稳定的炔丙基醛能进一步得到Michael产物 (式1)[2]。
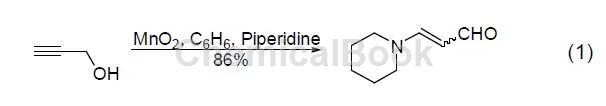
二、苯基醇和杂环醇的氧化
共轭芳醛或酮可以由MnO2氧化芳基醇得到,而同时很多其它的官能团却不会参与反应 (式2)[3]。
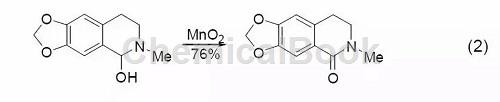
三、饱和醇的氧化
饱和的脂肪醇和脂肪环醇与MnO2反应可以高产率得到饱和的醛或酮(式3)[4]。1,2-二醇很容易被MnO2氧化为醛或酮,而1,2-环二醇则反应生成二醛或者是二酮,这在很大程度上决定于反应物的结构。
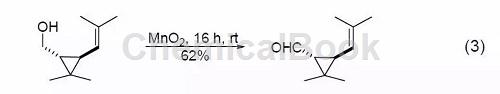
四、胺与炔的合成
在硼氢化钠存在下,α,β-不饱和烯醇氧化后可以与胺进一步反应 (式4)[5]。一级醇在MnO2氧化后用Bestmann-Ohira试剂(Seyferth-Gilbert增碳反应)处理可以得到端炔 (式5)[6]。
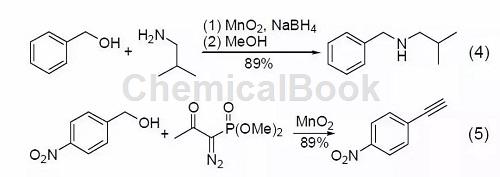
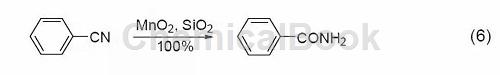
五、氰基转化为酰胺
在硅胶的参与下,MnO2能把氰基转化为酰胺 (式6)[7]。
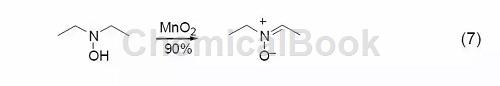
六、胺类化合物的氧化
用MnO2氧化胺可以得到甲酰胺、重氮化合物等。二烷基羟胺用MnO2氧化会得到相应的硝酮 (式7)[8]。
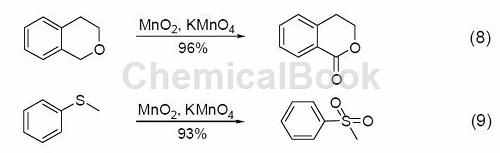
七、其它反应
MnO2 也可以用来发生其它反应,如α-羟基酸的裂解、二芳基甲烷的氧化、二芳基酮的转化、醛到羧酸的转化、由硫制备二硫化物、由磷制备磷化物或是由胺制备酮。此外,近两年兴起的在二氧化锰中添加高锰酸钾的绿色循环方法也有了广泛应用 (式8,式9)[9]。
参考文献
1. Hudlicky, M. Oxidations in Organic Chemistry, American Chemical Society: Washington, 1990.
2. Makin, S. M.; Ismail, A. A.; Yastrebov, V. V.; Petrv, K. I. Zh. Org. Khim., 1971, 7, 21210 (CA 1972, 76, 13712).
3. Hansel, R.; Su, T. L.; Schulz, J. Chem. Ber., 1977, 110, 3664.
4. Crombie, L.; Crossley, J. J. Chem. Soc., 1963, 4983.
5. Kanno, H.; Taylor, R. J. K. Tetrahedron Lett., 2002, 43, 7337.
6. Quesada, E.; Taylor, R. J. K. Tetrahedron Lett., 2005, 46, 6473.
7. Liu, K. T.; Shin, M. H.; Huang, H. W.; Hu, C. J. Synthesis, 1988, 715.
8. Cicchi, S.; Marradi, M.; Goti, A.; Brandi, A. Tetrahedron Lett., 2001, 42, 6503.
9. Shaabani, A.; Mirzaei, P.; Naderia, S.; Lee, D. G. Tetrahedron,2004, 60, 11415.
