| 外観 | 白色~ほとんど白色, 結晶~粉末 |
| 種類 | ヨウ素酸は、主に研究開発用試薬製品や、産業用ファインケミカルとして一般に販売されています。通常、室温で取り扱い可能な試薬製品として扱われます。 |
| 性質 | ヨウ素のオキソ酸の一つ。ヨウ素を発煙硝酸または塩素酸水溶液と加温してつくる。あるいは五酸化二ヨウ素I2O5を水に溶かしてつくる。特異臭のある無色の結晶。加熱すると、約70℃から脱水が始まり、110℃で融解してHI3O8(比重4.734)となり、220℃で五酸化二ヨウ素I2O5になる。光で徐々に分解する。吸湿性はない。水100グラムに310グラム溶ける(16℃)。水溶液は酸性で、強い酸化剤である。ヨウ素酸塩MIIO3は、アルカリ金属やアルカリ土類金属の水酸化物溶液にヨウ素を加えて熱するか、塩素酸塩水溶液にヨウ素を反応させてつくる。一価金属塩はナトリウム塩(五水和物)のほかは無水塩で、二価金属塩には無水塩、一水和物、二水和物、四水和物がある。塩素酸塩や臭素酸塩より安定であるが、酸化力が強く、炭素、有機物と混ぜて熱すると爆発する。ヨウ化水素を酸化してヨウ素と水にする。 HIO3+5HI⇌3I2+3H2O 水溶液は硝酸銀、塩化バリウム、酢酸鉛で無色の沈殿を生じる。ヨウ素酸カリウムKIO3の標準液を用いる酸化滴定はヨウ素酸塩滴定とよばれ、ヨウ化物、亜ヒ酸塩、タリウム(Ⅰ)塩、ヒドラジンなどの定量に用いられる。 |
| 溶解性 | 水に極めて溶けやすい。水に溶け、エタノールに微溶、エーテルに不溶。 |
| 解説 | ヨウ素酸 (英: Iodic acid) とは、ヨウ素のオキソ酸の一種で、化学式HIO3であらわされる無機化合物です。
CAS登録番号は、7782-68-5です。比較的強い酸であり、強い酸化力を持ちます。また、他のハロゲン化物のオキソ酸と異なり、結晶として単離することが可能な物質です。
|
| 反応性 | HIO3.ヨウ素のオキソ酸には,IⅠのモノオキソヨウ素(Ⅰ)酸 HIO,IⅤのヨウ素酸HIO3,IⅦの過ヨウ素酸HIO4,およびオルト過ヨウ素酸や各種イソポリ酸などがあるが,単にヨウ素酸といった場合には,IUPAC,学術用語ともに,HIO3に限定される.HIⅤ O3(175.91)はI2O5と水との反応や,I2 を発煙硝酸などと加熱酸化,濃縮して沈殿させるか,Ba(IO3)2とH2SO4との反応から得られる.α,β形の二変態がある.分解点110 ℃.70 ℃ で水を失って,HI3O3になり,200 ℃ でI2O5になる.水に易溶だが,潮解性はない.エタノールに微溶,エーテルに不溶.強い酸(Ka 約0.169(25 ℃))で,強い酸化力をもつ.森北出版「化学辞典(第2版) |
| 用途 | 分析用試薬 : 硝酸酸性溶液中で水銀(II)、鉛と作る沈殿が、これらの金属の定量(重量法)に利用される。 |
| 合成 | 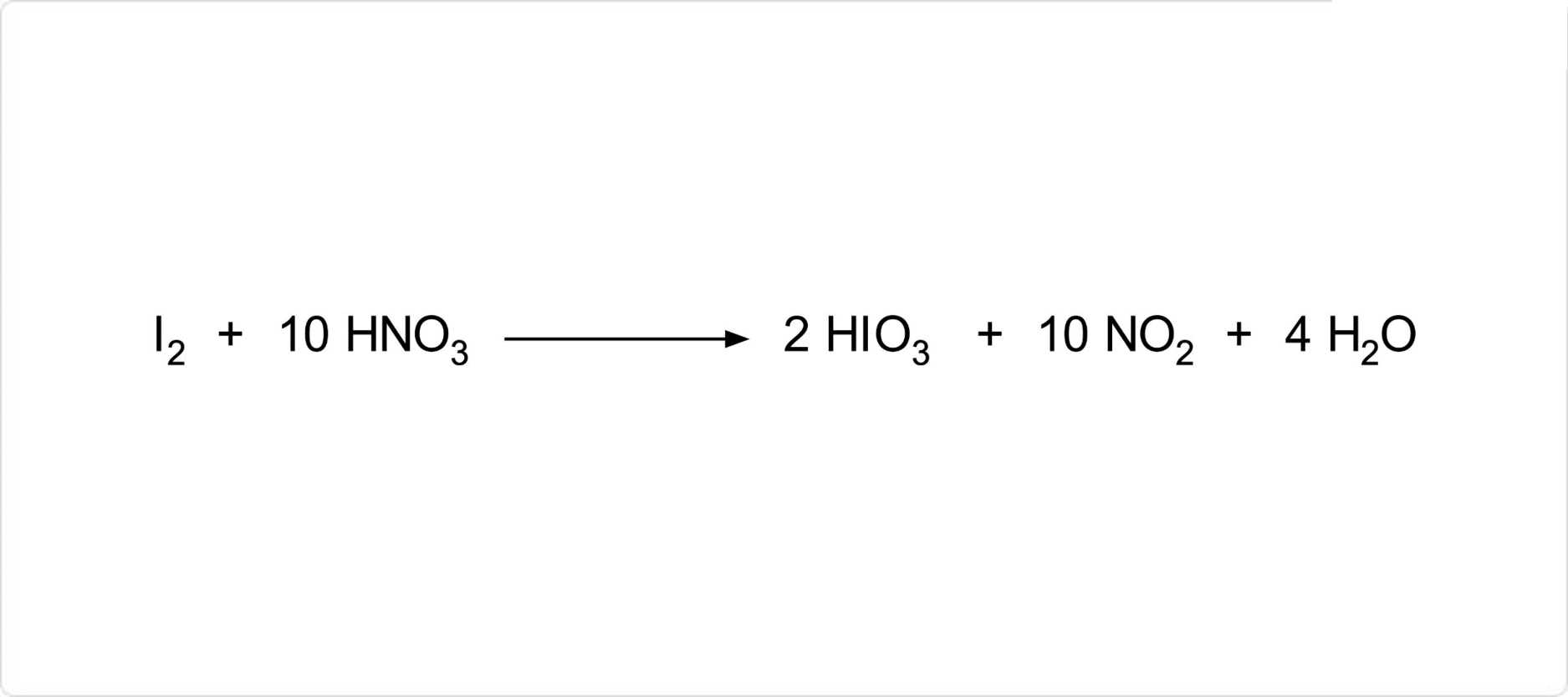
図1. ヨウ素酸の合成
ヨウ素酸の製造方法は、、またはや、次亜塩素酸、過酸化水素などを使用してヨウ素を酸化する方法が知られています。それ以外では、五酸化二ヨウ素を水に溶解する方法があります。 |
| 化学的特性 | colorless, rhomb crystal(s) or white, crystal(s) powder(s); darkens on exposure to light; it is a moderately strong acid; used in analytical chemistry and in medicine [HAW93] [MER06] |
| 物理的性質 | Iodic acid, HIO3, can be obtained as a white solid. It
dissolves in water very well, but it also exists in the
pure state, as opposed to chloric acid or bromic acid.
Iodic acid contains iodine in the oxidation state+5
and it is one of the most stable oxo-acids of the halogens
in its pure state. When iodic acid is carefully heated, it
dehydrates to iodine pentoxide. On subsequent heating,
the iodine pentoxide further decomposes, giving
a mixture of iodine, oxygen and lower oxides of iodine.
Iodic acid can be produced by oxidizing I2 with
chlorine in an aqueous solution. Iodic acid can be
used to synthesize sodium or potassium iodate salts
(which are used in salt as a source of iodine in the
human body. |
| 使用 | A strong acid in analytical chemistry. |
| 使用 | Iodic acid is used in analytical chemistry laboratories to standardize solutions of both weak and strong bases using methyl red or methyl orange as the indicator. It acts as a key starting material to synthesize sodium or potassium iodate, thereby increasing the iodine content of salt. |
| 定義 | iodic acid: Any of various oxoacids of iodine, such as iodic(V) acid and iodic(VII) acid. When used without an oxidation state specifled, the term usually refers to iodic(V) acid (HIO3). |
| 製造方法 | Iodic acid may be prepared by the reaction of sulfuric acid with bariumiodate. The solution is filtered to remove barium sulfate and then crystallizedto obtain iodic acid:
Ba(IO3)2 + H2SO4 → BaSO4 + 2HIO3
It also may be produced by oxidation of iodine with concentrated nitric acid:
3I2 + 10HNO3 → 6HIO3 + 10NO + 2H2O
Also, iodic acid may be obtained by oxidation of iodine with chlorine in diluteacidic solutions:
I2 + 5Cl2 + 6H2O → 2HIO3 + 10HCl
Another method of preparation involves oxidation of iodine with hydrogenperoxide:
I2 + 5H2O2 → 2HIO3 + 4H2O
It also may be prepared by treating hypoiodous acid with a base:
3HIO + 2OH¯ → HIO3 + 2H2O + I¯
Hypoiodous acid may be obtained by alkaline hydrolysis of iodine at pH 12:
I2 + H2O → HIO + H+ + I¯
Iodic acid dehydrates to iodine pentaoxide when heated at 180°C:
2HIO3 → I2H5 + H2O
Iodic acid is a relatively weak monoprotic acid, the Ka value at 25°C is 1.6x10-1. Several species have been detected in concentrated aqueous solutions,which include IO3-, H+, HIO3, (HIO3)2 and (HIO3)3. Its solution turns blue lit-mus red and then bleaches the litmus paper because of its strong oxidizingproperties.
When heated with potassium iodate, potassium hydrogen iodate is formed:
HIO3 + KIO3 → KH(IO3)2
An aqueous solution of iodic acid is a strong oxidizing agent. It liberates iodine from iodides:
IO3¯ + 5I¯ + 6H+ → 3I2 + 3H2O or, HIO3 + 5HI → 3I2 + 3H2O
In an aqueous solution, iodic acid oxidizes hydrogen sulfide to sulfur:
2HIO3 + 5H2S → I2 + 6H2O + 5S
The solid iodic acid reacts vigorously with sulfur, phosphorus and other non-metals. |
| 一般的な説明 | Iodic acid is the hydrated form of I2O5. Reaction of iodic acid with hydrogen iodide has been described by electrolytic dissociation theory. Combustion of mixture of chromic, iodic, sulfuric and phosphoric acids has been proposed. Its Raman spectra have been recorded. Vibrational assignment of IO3- has been evaluated. |
| 危険性 | Toxic by ingestion, strong irritant to eyes
and skin. |
| 化学反応 | 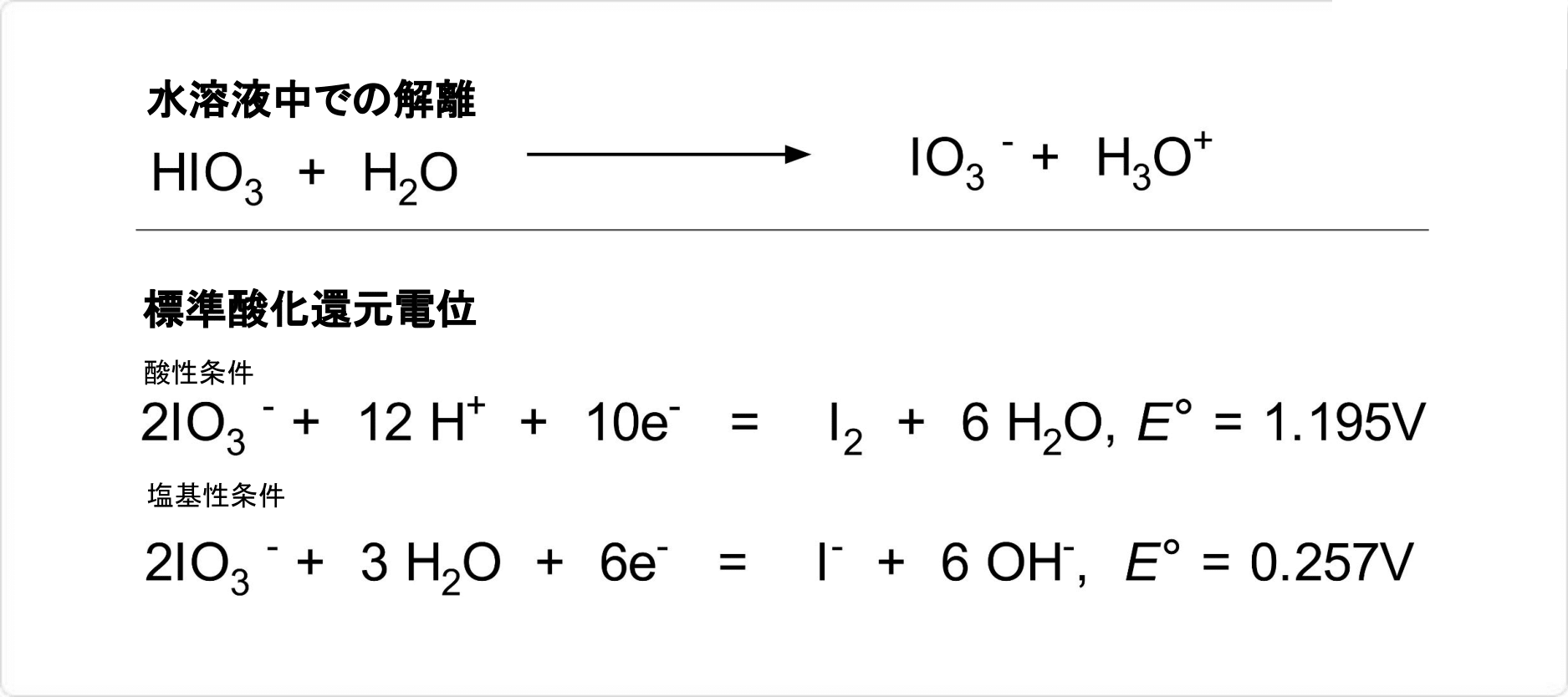
図2. ヨウ素酸の水溶液中での解離と標準酸化還元電位
ヨウ素酸は、水溶液中では酸性を示し、解離してヨウ素酸イオンを生じる物質です。酸性溶液中では強い酸化剤としてはたらきますが、塩基性溶液では酸化力は弱い性質があります。
強力な酸化剤であるため、還元性物質や可燃性物質とは反応性がある物質です。また、光により変質するおそれがあります。保管の際は、有機物、可燃物、アルコール類、金属類、還元剤との混触を避けるべきとされます。 |
| 有害性情報 | ヨウ素酸は、GHS分類において、皮膚腐食性・刺激性のある酸化性固体であると認められています。
ヨウ素酸は、労働安全衛生法において、名称等を表示すべき危険物及び有害物、及び、名称等を通知すべき危険物及び有害物に指定されている物質です。また、ヨウ素酸単体は消防法での規制はありませんが、各種ヨウ素酸塩 (ヨウ素酸アンモニウムなど) は、消防法において危険物第1類に指定されています。
|
| 使用用途 | ヨウ素酸の主な使用用途は、医療用の収れん剤、殺菌消毒剤、分析試薬です。ヨウ素酸は、空気中で比較的安定であるため、取り扱いが容易な物質です。収れん剤や殺菌消毒剤としてのヨウ素酸は、ヨウ素の持つ酸化作用による各種菌やウイルスに対する殺菌消毒作用を利用しています。
また、ヨウ素酸は分析化学の分野において、各種ヨウ素化合物、特にの定量を目的とする滴定試薬としてしばしば用いられます。これはヨウ素酸の酸化剤としての性質を利用したものです。水銀や鉛の定量にも利用されます。また、強酸として酸塩基滴定に用いることも可能です。この場合は、メチルレッドやメチルオレンジを指示薬として弱および強塩基の滴定に利用されています。
|
| 純化方法 | Dissolve iodic acid in the minimum volume of hot dilute HNO3, filter and evaporate in a vacuum desiccator until crystals are formed. Collect the crystals and wash them with a little cold H2O and dry them in air in the dark. It is soluble in H2O: 269g/100mL at 20o and 295g/100mL at 40o. It is soluble in dilute EtOH and darkens on exposure to light. It is converted to HIO3.I2O5 on heating at 70o, but at 220o complete conversion to HIO3 occurs. [Lamb et al. J Am Chem Soc 42 1636 1920, Bray & Caulkins J Am Chem Soc 53 44 1931.] |