在疾病与代谢研究中,一条清晰、严谨的研究路线是推进课题的“导航仪”。按照“多组学初筛锁定候选靶点 → 构建疾病模型并验证表型与功能 → 深入解析信号通路及作用机制 → 小分子药物的发现与体内外验证”这一四步闭环,可迅速梳理实验逻辑。下面小优就以两篇高分文献为例,带您逐层拆解。
2025年2月,中国药科大学杨鹏、肖易倍、郝海平教授团队和南京医科大学姜玉章教授团队合作在《Nature Cancer》期刊发表文章,证明了高表达的ADAR1是前列腺癌(PCa)中一个重要的致癌靶点,并开发了一种有效的小分子ADAR1抑制剂ZYS-1,具有显著的抗肿瘤疗效和良好的安全性。

PART1 多组学初筛(靶点发现):ADAR1在前列腺癌中是一个值得关注的致癌靶点
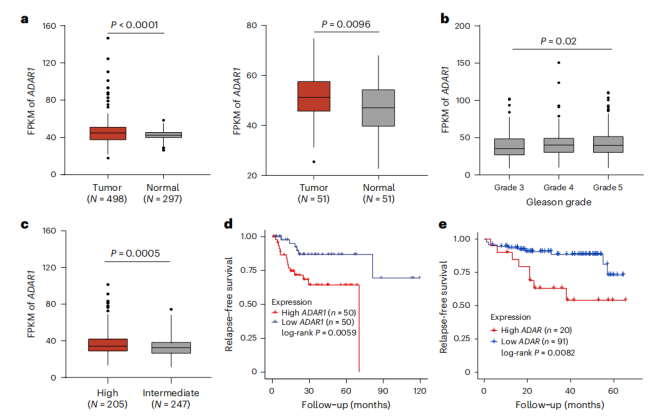
通过分析TCGA和GDC数据库,作者发现ADAR1在前列腺癌组织中显著高表达,且与高风险、高Gleason分级及不良生存预后密切相关。在组织芯片和多种前列腺癌细胞系中进一步验证,ADAR1蛋白水平明显高于正常组织;RNA-seq显示肿瘤内A-to-I编辑事件显著增多,提示ADAR1活性增强。免疫浸润分析表明,ADAR1高表达与CD8⁺T细胞、M1巨噬细胞减少及免疫检查点分子升高呈负相关,暗示其营造免疫抑制微环境,进一步支持其作为治疗靶点的潜力。
部分相关热卖产品
PART2 造模+表型/功能检测:ADAR1对肿瘤细胞存活至关重要
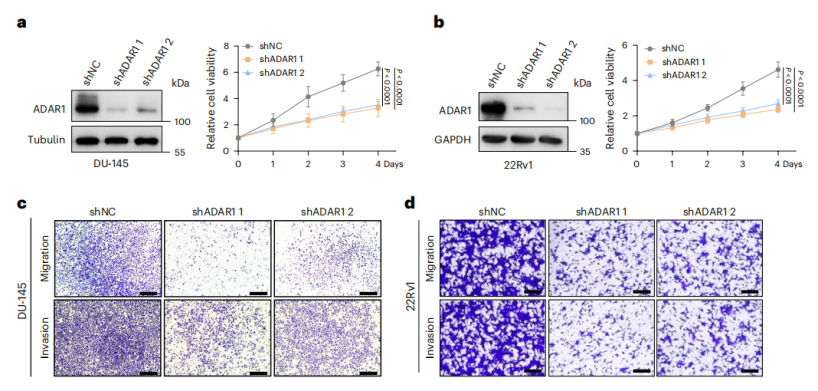
作者在DU-145、VCaP和22Rv1三株前列腺癌细胞中敲低ADAR1后,细胞增殖、迁移和侵袭能力均显著下降,同时出现G0/G1期阻滞和凋亡增加;CRISPR-Cas9敲除ADAR1亦证实这些表型,且裸鼠成瘤实验几乎完全失败,表明ADAR1对肿瘤体内外存活至关重要。反之,过表达野生型ADAR1可恢复细胞增殖和A-to-I编辑水平,而催化失活突变体无此效应,证明ADAR1依赖其脱氨酶活性促进前列腺癌细胞生长。
部分相关热卖产品
PART3 信号通路/机制研究:ADAR1调节肿瘤生存和IFN应答信号并以编辑依赖的方式抑制MTDH的翻译
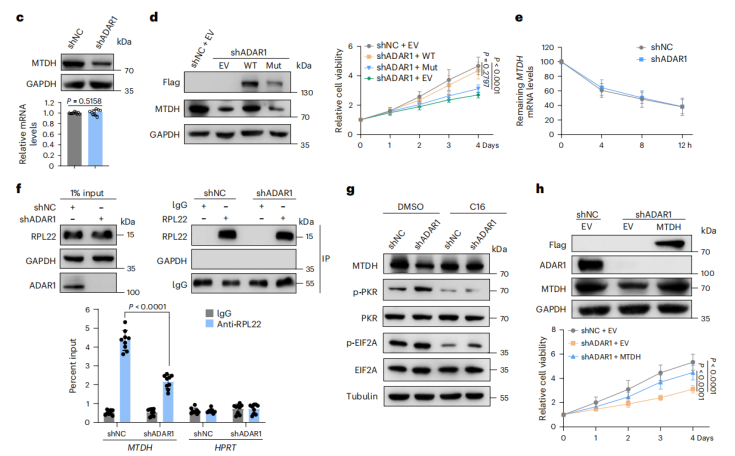
RNA-seq显示,敲低ADAR1后,DU-145和22Rv1细胞中MYC、E2F和G2/M检查点通路显著下调,而p53、细胞黏附分子及I型干扰素(IFN)信号通路明显上调,提示ADAR1通过抑制IFN应答和维持增殖信号促进肿瘤存活。ADAR1缺失导致细胞内双链RNA感应通路激活,IFNβ分泌增加,关键感应蛋白RIG-I、MDA5和MAVS表达上升,而cGAS-STING通路未被激活,表明ADAR1主要阻断dsRNA-MAVS介导的I型IFN信号。
多组学筛选发现ADAR1直接结合并编辑MTDH mRNA的3′UTR;TCGA数据和患者组织验证显示,MTDH表达与ADAR1呈正相关,且肿瘤中其编辑水平和蛋白水平均显著高于正常组织。机制研究表明,ADAR1缺失不影响MTDH mRNA总量,却使其蛋白水平骤降;CHIP实验表明ADAR1通过增强MTDH 3′UTR的A-to-I编辑提高其翻译效率,且该过程依赖ADAR1的脱氨酶活性。在ADAR1敲低细胞中过表达MTDH可显著恢复增殖、迁移和侵袭能力,表明MTDH是ADAR1下游关键功能靶点,介导ADAR1促癌作用。
PART4 小分子药物发现和验证:ZYS-1抑制PCa细胞生长并触发IFN反应
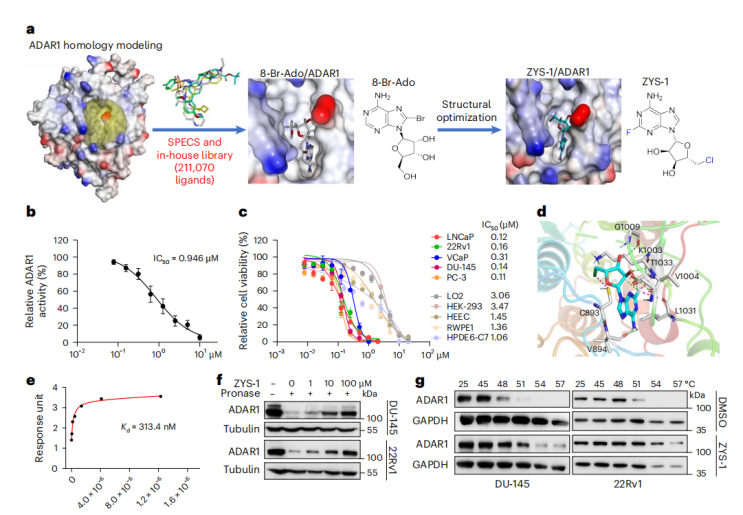
作者采用基于结构的虚拟筛选,经过2轮筛选出8-Br-Ado分子,对ADAR1酶活抑制约30%,作为先导化合物进行结构优化,最终合成出新化合物ZYS-1,其体外抑制ADAR1脱氨酶活性的IC₅₀达0.946 μM,对多种前列腺癌细胞系的抗增殖活性进入亚微摩尔级别,而对正常细胞毒性显著降低。分子对接与动力学模拟显示,ZYS-1在ADAR1催化口袋形成额外σ-hole相互作用;Biacore实验测得结合亲和力KD=313 nM;DARTS和CETSA实验进一步证实ZYS-1可直接、特异性地结合并稳定ADAR1蛋白。
进一步验证表明,ZYS-1以剂量依赖方式抑制前列腺癌细胞增殖、集落形成、迁移和侵袭,并诱导G0/G1期阻滞与显著凋亡。RNA-seq显示,ZYS-1处理重现ADAR1敲低效应:全局A-to-I编辑水平下降,IFNα/γ、TNF-NF-κB、p53和凋亡通路上调,MYC、G2M和E2F靶标下调。机制上,ZYS-1激活MDA5/RIG-I/MAVS轴,显著增加IFNβ分泌;PKR主要介导生长阻滞,MDA5主导IFN应答,且MTDH蛋白因编辑减少和PKR-eIF2α激活而被抑制,共同阻断肿瘤存活。
2022年11月,上海交通大学胡承团队在Nature Communications发表题为“GPSM1 impairs metabolic homeostasis by controlling a pro-inflammatory pathway in macrophages”的研究论文,该研究揭示了巨噬细胞GPSM1(G蛋白信号调节剂1)促进代谢炎症以加速T2D和肥胖发展的机制。GPSM1与T2D和体重指数BMI强相关,针对GPSM1靶点,研究团队利用Biacore筛选和鉴定出一种小分子化合物AN-465/42243987,它通过抑制GPSM1功能来抑制促炎表型,可以成为代谢治疗的候选药物。

PART1:多组学初筛(靶点发现):小鼠肥胖中巨噬细胞GPSM1表达上调
GWASs数据库表明GPSM1是2型糖尿病(T2D)的易感基因。多组学研究表明在高脂饮食或遗传肥胖(ob/ob、db/db)小鼠的内脏和皮下白色脂肪组织中,GPSM1的mRNA和蛋白水平均显著高于瘦小鼠;免疫染色和流式进一步证实,这种上调主要发生在脂肪组织巨噬细胞(ATMs)中。
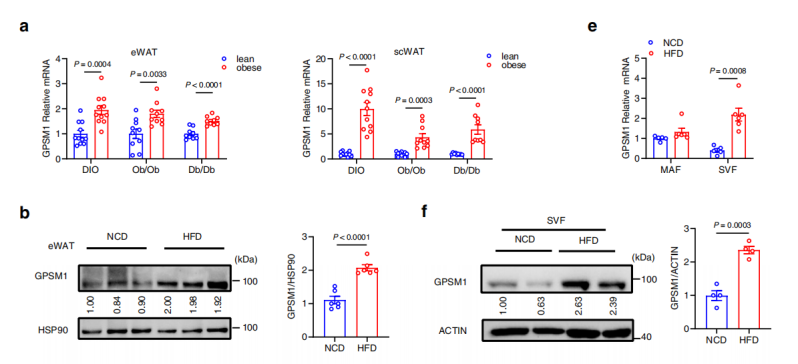
PART2 造模+表型/功能检测:髓系细胞中GPSM1缺失可减轻代谢性炎症并增加能量消耗
髓系缺失 GPSM1 直接减少脂肪巨噬细胞(尤其 M1)浸润和炎症因子,局部和全身炎症随之下降;这种抗炎效应发生在肥胖和胰岛素抵抗之前,且只依赖于巨噬细胞,与中性粒细胞无关。
髓系缺失 GPSM1 不影响进食与活动,但可提高氧耗、增强棕色脂肪 UCP1 及产热基因表达,说明其通过激活 BAT 而增加能量消耗,部分抵抗肥胖。

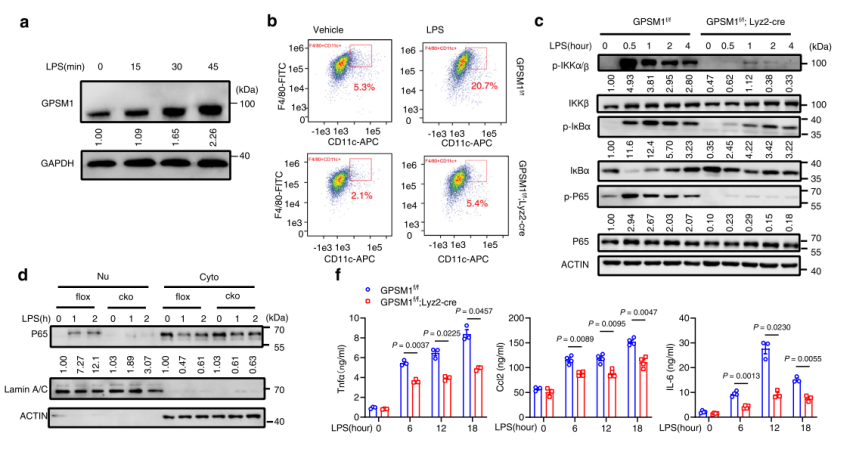
PART3 信号通路/机制研究:巨噬细胞中GPSM1被LPS激活后,通过Gαi3/cAMP/PKA/CREB轴抑制TNFAIP3的转录,从而刺激NF -κB信号。
缺失 GPSM1 显著抑制 IKKα/β 磷酸化、IκBα 降解及 P65 磷酸化与核转位,随之减少成熟 IL-1β(p17)、活性 caspase-1(p20) 的生成,并降低 TNF-α、IL-6、CCL2 分泌。
RNA-seq 筛选发现 TNFAIP3(A20)是唯一在两组巨噬细胞中均被 GPSM1 负向调控的下游基因。GPSM1 缺失显著上调 A20 蛋白,从而抑制 NF-κB 信号与炎症;而 A20 敲低或构建髓系 GPSM1/TNFAIP3 双敲小鼠可完全逆转上述抗炎效应。
PART4 小分子药物发现和验证:ZYS-1抑制PCa细胞生长并触发IFN反应
作者采用计算与实验相结合的混合策略筛选潜在的GPSM1抑制剂。作者推测存在潜在的别构位点针对于GPSM1抑制。通过AlloSitePro方法在AlphaFold预测GPSM1结构,作者发现了1个潜在别构位点。基于该预测位点,作者对SPECS化合物库中的270,000种化合物进行了高通量虚拟筛选(HTVS)。随后,根据GPSM1—化合物结合模式的优先级排序,最终筛选出93种化合物。
为评估这些化合物与GPSM1的活性,作者通过Biacore 8K对这93种化合物进行筛选,最终筛选出10种代表性小分子。
方法如下:
GPSM1重组蛋白使用PH 4.0的醋酸钠缓冲液进行稀释,终浓度为20ug/ml。通过Biacore的偶联程序和氨基偶联试剂将GPSM1重组蛋白偶联在CM5芯片上,目标偶联量设置为10000 RU。小分子药物稀释成终浓度为50 umol/L,依次流经芯片表面,缓冲液为PBS-T和5% DMSO。初步检测不同小分子药物和GPSM1的结合能力。
进一步验证表明,化合物7 AN-465/42243987能显著抑制促炎表型。
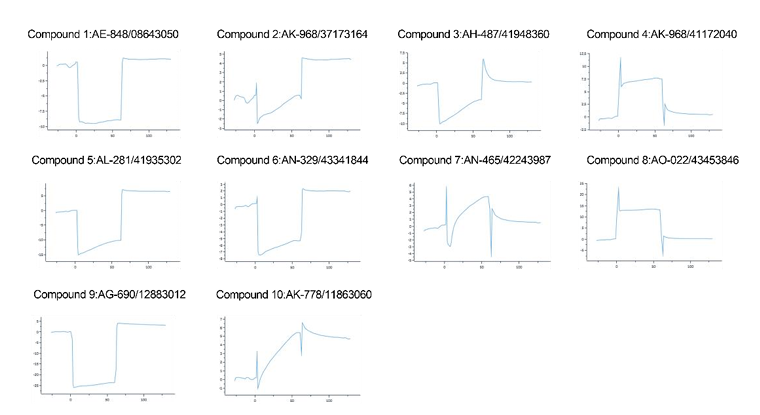
Biacore筛选小分子化合物
然后,作者继续通过Biacore验证AN-465/42243987与GPSM1的结合能力。结果表明,AN-465/42243987与GPSM1的亲和力为3.47×10-4 M,可作为T2D的候选药物。
方法如下:
GPSM1重组蛋白使用PH 4.0的醋酸钠缓冲液进行稀释,终浓度为20ug/ml。通过Biacore的偶联程序和氨基偶联试剂将GPSM1重组蛋白偶联在CM5芯片上,目标偶联量设置为10000 RU。缓冲液包含PBS-T和5% DMSO。AN-465/42243987稀释成浓度梯度(3.125,6.25,12.5,25和50 uM),以30 ul/min的速率进样120s。在解离阶段,使用缓冲液以30 ul/min的速率进样120s。使用亲和力检测的程序进行亲和力检测。
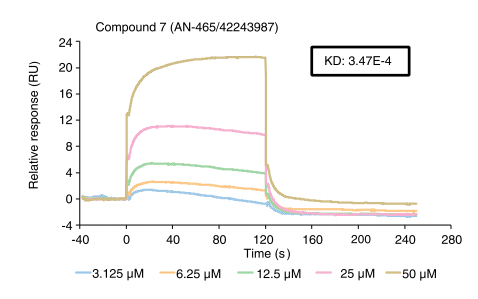
Biacore验证AN-465/42243987与GPSM1的结合能力
在小分子药物筛选和检测中,难点通常在于小分子的分子量极小,需要仪器具备极高的灵敏度,才能检测到好结果。Biacore基于SPR原理,作为分子互作领域的金标准,其具备的超高灵敏度实现了不仅可以检测大分子,对小分子检测无分子量下限。Biacore亲和力及动力学检测范围极宽,可以检测到小分子化合物与靶点的弱亲和作用,所以在小分子药物的筛选和检测中发挥着不可替代的作用。同时,多平行进样针和内置筛选程序也可以满足高通量筛选的需求。
Biacore试剂耗材相关货号
Series S Sensor chip CM7, 3-pack
Series S Sensor Chip SA-1-pack
Series S Sensor Chip NTA, 1-pack
优宁维为您提供一站式解决方案

相关热卖产品
PolyFect Transfection Reagent
New Zealand Characterized Foetal Bovine Serum
Annexin V-FITC/PI细胞凋亡检测试剂盒
Wnt Signaling Antibody Sampler Kit
Phospho-MAPK Family Antibody Sampler Kit
Apoptosis Antibody Sampler Kit
Phospho-Akt Pathway Antibody Sampler Kit
0.45UM PVDF 300MMx4M 1/PK
β-Catenin (D10A8) XP Rabbit mAb
Phospho- β-Catenin (Ser33/37/Thr41) Antibody
Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb
Phospho-Akt (Ser473) (D9E) XP Rabbit mAb
Phospho-NF-κB p65 (Ser536) (93H1) Rabbit mAb
GLUTATHIONE SEPHAROSE 4B 10 ML
Superdex 200 Increase 10/300 GL
Series S Sensor chip CM7, 3-pack
Series S Sensor Chip SA-1-pack
Series S Sensor Chip NTA, 1-pack
GLUTATHIONE SEPHAROSE 4B 10 ML
Superdex 200 Increase 10/300 GL
Superdex 75 Increase 10/300 GL
Superose 6 Increase 10/300 GL