铯性质、用途与生产工艺
铯,原子量132.90545(2)。原子序数55。银白色六方晶系金属(单质的洁净面显金黄色)。质轻软且可延。熔点28.55±0.16℃,沸点669.5℃,相对密度1.873。在碱金属中,是电正性最高的强碱性元素。与冷水反应发生爆炸。-116℃时,仍可与水反应。可溶于液氨,生成氨基化合物和氢气。能与卤素、磷、硫直接反应生成相应二元化合物。存在于铯榴石、光卤石以及鳞云母矿中。由电解熔融氯化铯而得。极纯的气态铯可由叠氮化铯的热分解而制得。铯单质主要用于制造光电管、摄谱仪、闪烁计数器、电子管、红外信号灯、以及光学自动控制仪器,还用于电子管的吸氧剂。医疗中用铯盐做药物。同位素铯-137,可用来治疗癌症。

1860年德国化学家本森(R.Bunsen)和基尔霍夫 (G.R.Kirchoff) 在研究矿泉水的光谱时发现铯,这是第一个用光谱法发现的元素,根据其光谱线的颜色按拉丁文Caesius(天蓝色)取名为Cesium(铯)。塞特伯格(C.Setterberg)于1881年电解氰化铯-氰化钡混合熔盐时,首次制得金属铯。铯在制得以后60余年中未获工业应用。1926年开始用铯制造光电管,但用量极小。第一次世界大战前只有德国生产少量铯,产量仅几千克。20世纪30年代美国开始生产铯。第二次世界大战期间,铯作为光敏材料,用量增加,但由于铯价格昂贵而稀少,应用受到限制。1957年美国研究成功从锂云母提锂后的母液——混合碳酸碱液(含Cs2O2%和Rb2O23%)中回收铯、铷的方法,导致铯产量骤增。铯作为锂生产的副产品,成本低,价格也随之显著下降,从而大大推动了铯的应用和对铯性质的研究。20世纪60年代以来,铯在原子钟、光学仪器、激光、有机合成等方面获得应用,同时还开发了多种提铯方法,使铯的提取冶金技术达到相当水平,产品质量不断提高,价格进一步下降。中国于1956年开始铯的冶炼研究,60年代初开始生产铯,相继开发了新疆、江西、四川等省的铯资源,现已能生产20余种铯、铷产品,满足国内经济发展和科学研究对铯的需要。
金属铯为体心立方晶体结构,质软,有延性,可用刀切割。铯原子的外电子层构型为[Xe]6s1。在碱金属中铯的熔点和沸点最低,蒸气压最高,密度最大,导热性和导电性最好,电离电位最小。铯有22种同位素,其质量数在123~144之间。自然界中的133Cs为稳定同位素。放射性同位素137Cs是原子反应堆的聚变产物,半衰期为30.23a。

图1为铯的主要物理性质
有关铯的概述、物理性质、化学性质、制备方法等是由Chemicalbook的侍艳编辑整理。(2015-11-16)
铯具有所有碱金属的化学特性,是碱金属化学反应活性最强的元素。常见的铯化合价为正一价,由Cs+→Cs0的还原电位为-2.923V。铯和铷性质相近,较难分离。金属铯在空气中燃烧时会喷溅出浓密的碱性烟雾,这种碱性烟雾能伤害眼睛、呼吸系统和皮肤。铯在潮湿的空气中氧化放出的热量足以使铯点燃并熔化。铯和氧剧烈反应生成多种氧化物的混合物。铯有Cs-1(s2)和Cs+两种氧化态。铯与水作用会发生强烈爆炸,甚至与157K温度的冰接触也剧烈反应,生成氢氧化物,放出氢气。和锂不同,铯不与氮反应。铯在高温下与氢反应生成相当稳定的氢化物。铯和乙炔反应生成乙炔化物。铯和卤素剧烈反应不同于其他碱金属与卤素的反应,铯能生成稳定的多卤化物,如CsI3。铯和氨反应生成氨基化铯 (CsNH2)。在低温下铯和CO反应生成一种组成不定的晶体化合物。碳酸铯可被金属镁还原成金属铯,氯化铯可被钙还原。铯和其他碱金属可形成低熔点的液体合金,如Cs-12Na-47K合金,其熔点195K;Cs~13Rb合金,其熔点234K;Cs-55Na合金,其熔点244K。铯盐可生成极难溶的矾,如CsCl·SbCl3。冶炼上利用铯矾的难溶特性来分离铯,分析上用以定量测定铯的含量。
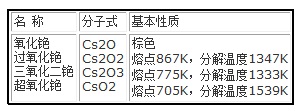
图2为铯的主要化合物及其基本性质
铯的地壳丰度是锂、钠、钾、铷、铯五种碱金属元素中最小的,为2.6×10-4%,海水含铯5×10-8%。铯常和锂、铷、钾共生。虽然铯比铷的地壳丰度小得多,但铯有工业用独立矿物。
锂云母是提取铯的主要资源之一。一些锂云母矿含铯较高,如美国加利福尼亚的锂云母矿含CszOO.30%,前苏联科拉半岛的锂云母含Cs20 O.24%。津巴布韦比基塔地区的锂云母储量大,但仅含cs。OO.08%。铯榴石是铯的重要工业资源,主要产于美国的缅因州、加拿大的伯尼克湖、津巴布韦的比基塔地区和纳米比亚的卡里比布}此外,亦有少量产于瑞典、莫桑比克及东哈萨克斯坦。一般铯榴石含铯甚高,含锂、铷较低,有的甚至含铷很少。如美国缅因州的铯榴石含Csz0 36%、Li20 0.04%,前苏联科拉半岛的铯榴石含Cs20 27.1%,意大利厄尔巴岛的铯榴石含Cs:O 34%(Liz0痕量)。中国新疆的铯榴石含Cs:0 29%~30%。以上矿物几乎都不含铷。此外,加拿大伯尔尼克湖的铯榴石含Cs20 28.6%、Rb20 1.36%、Li20 O.31%;津巴布韦比基塔的铯榴石含Cs20 22.4%、Rb20O.84%、Li20 O.30%。光卤石也是铯的重要来源,主要产于德国。前苏联科拉半岛拥有世界最大的光卤石产地。盐湖、地下卤水、气田水、油井水、温泉水及地热水都蕴藏有大量的铯,有的含铯量比较高。如美国索尔顿的湖水含cszO(16~21)×10-‘%,伍德湖油田水含Csa0 25×10-‘%。世界已查明的铯总储量为120000t,其中加拿大80000t,津巴布韦25000t,纳米比亚10000t。中国铯资源丰富,主要分布在江西的宜春、新疆的可可托海、四川的康定、湖南的香花岭和青海。江西的锂云母含Cs20 O.3%、Rb。0 1.72%,是中国最大的铯资源基地。中国盐湖卤水多,铯资源丰富,青藏高原卤水平均含cs。0 O.03g/L,四川的自贡卤水中的铯也已得到开发利用。
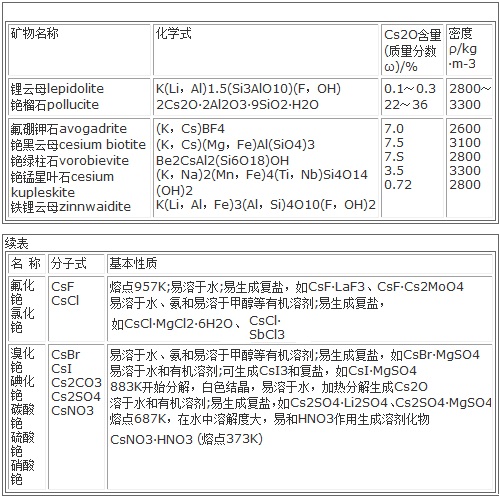
图3为主要的铯矿物
使铯榴石与氧化钙、氯化钙一起煅烧,可制得氯化铯,再经熔融电解,可制得金属铯。
2CsAlSi2O6+3CaO+CaCl2→ 2CsCl+Al2O3+4CaSiO3
2CsCl→2Cs+Cl2
主要包括铯提取(制取化合物)和金属铯制取两大步骤。有时为了获得高纯金属铯产品,需进行高纯金属铯制取。铯提取是从锂云母、铯榴石和光卤石等铯原料中提取铯化合物的过程。铯榴石提铯、铷有铯榴石盐酸法分解、铯榴石硫酸法分解、碱性熔盐焙烧、氯化焙烧和矿石直接还原等方法。工业上主要采用前两种方法。从铯原料中提取的铯化物常含有一定数量的杂质,需采用诸如溶剂萃取法提铯等方法制取纯的铯化合物,从铯榴石生产金属铯的工艺过程如图。
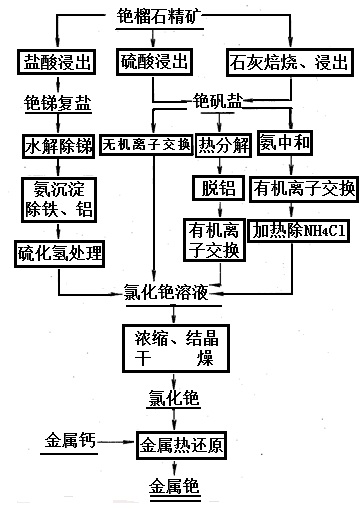
图4为从铯榴石生产金属铯的工艺流程
铯及其化合物主要用于高技术的研究和开发,如用于磁流体发电、热离子发电、涡轮发电及离子推进技术的研究和开发,这些技术都处在开发阶段。美国高技术用铯量占铯总用量的50%~70%。铯的工业应用主要是电子工业、玻璃陶瓷和药物。铯及其化合物的性质和铷类似,在许多应用场合二者可以互代,但铯的某些性质优于铷,如铯的光电转换灵敏度比铷高。磁流体发电是使各种燃料产生的高温导电流通过强磁场,在电感应作用下由热能直接转换成电能,铯作为诱导材料加入到燃料中,可降低燃料离子化所需温度,改善离子焰传导性,增加所产生的能量。一座60万kW磁流-蒸气联合电厂每年约需用3000t碳酸铯。热电换能器是利用热电子发射现象产生大电流输出的二极管,将热能直接转换为电能,用铯制作的二极管可以提高热离子发电机的发电效率。气化的金属铯被离子化后,在电场作用下可加速到接近光速,再被电子束中和并从引擎中喷出,能产生强大的推动力。以铯为推进剂的火箭发动机比冲可达2000s (大多数化学燃料比冲仅300~400s)。一艘带有500g铯的离子推进宇宙飞船的航程大约是常用燃料飞船的150倍。普通光线的能量就足以使铯游离出价电子,铯的这一特性被用于制造光电管、摄谱仪、无线电电子管、军用红外信号灯及各种光学仪器和检测仪器中,使用铯光电池电源的寻靶导弹头,可跟踪、拦截敌方的飞行物。电视技术中采用铯阴极制造的低压电子束摄像管。铯的卤化物具有发光性能,用于制造闪烁计数器。钠激活的碘化铯对X射线的阻挡能力比其他卤化物大得多,用其制造的图像增强管具有很高的分辨力、强度和稳固性,使医用X光机不用暗室就可供多人观察而不受X射线的辐射。许多国家用铯原子钟作频率和时间标准,其精度达到1×10-13s,广泛用于通讯、运输、军事和宇航工业。硝酸铯是多成分特种玻璃的光折射调整剂,广泛用于光学纤维和纤维质透镜生产。铯的化学活性大,电离电位低,能改变主催化剂的表面性质,含铯的催化剂具有更好的催化活性、选择性和稳定性,可延长催化剂使用寿命,防止催化剂中毒。含铯的催化剂广泛用于氨合成,硫酸生产以及有机物的氧化、氢化、聚合、腈的形成等有机合成。铯盐具有镇静作用,可用于制造安眠药、镇静剂、癫痫治疗剂。137Cs作为放射性同位素标记用作诊断肿瘤,并正在取代60Co治疗癌症。氯化铯用于超速离心分离病毒、脱素核糖酸和其他大分子的密度-梯度介质。铯在冶金工业上被用作脱气剂和精炼剂。
极易引起火灾。接触潮湿空气着火,与空气中的氧反应生成超氧化物,当混有有机物时,产生爆炸性的反应。与水或酸接触剧烈反应,并放出氢气引起燃烧。与卤素、硫黄和氧化剂接触剧烈反应。毒性比钠更强,但尚无因铯而引起中毒病例报道。铯主要对眼睛、皮肤和黏膜有强刺激性和腐蚀性。大鼠腹腔LD
50:89 mg/kg。发生灼伤时,立即用水冲洗,伤口保洁,速送医院诊治。
化学性质
银白色有延展性的金属。相对密度1.892(18℃)。熔点28.44℃。沸点671℃。在潮湿空气中迅速氧化,能自燃着火。硬度0.2 Mohs。电阻率(0℃)19 μΩ?cm,(30℃)36.6μΩ?cm。比热容(20℃)0.217 J/(g?K)。熔化热2.087kJ/mol;汽化热68.85 kJ/mol。热导率:35.9 W/(m?K),在熔点时液体为18.4w/(m?K),在沸点时蒸气为0.0046w/(m?K)。与水反应释放出H2,溶于液氨。它是仅次于汞的易熔金属。铯的性质与钾相似,但比钾的反应性更强(碱金属中最活泼者)。与空气接触就着火,当混有有机物时就产生爆炸性反应。与水或酸类剧烈反应放出H2发生燃烧。有剧烈的反应性,有时有爆炸性
用途
光电元件。聚合反应的催化剂。红外线灯。原子钟。
用途
广泛用于电子工业、玻璃陶瓷工业、医药和冶金工业
用途
是制造真空件器、光电管等的重要材料,化学上用做催化剂。
生产方法
真空蒸馏法提纯 首先用扩散泵把装置抽成真空,将整个装置从A至E加热至400~450℃,使其干燥数小时。然后把提纯的氩气充满整个装置,切开A处,将装有带挥发油的金属铯的容器送人管B中,待挥发油蒸发后,把管B再次封住,将装置抽成真空(≤10
-6托),用电炉在E附近进行加热,使铯在管D蒸馏析出。靠装置旋转,使熔融的铯从管D流到安瓿中,冷却后,装置充满氩气,将安瓿熔融物切断,制得高纯铯。
类别
遇水燃烧物品
毒性分级
中毒
急性毒性
腹腔- 小鼠 LD50: 1700 毫克/ 公斤
爆炸物危险特性
遇水、湿空气、氧化剂放出氢气可爆
可燃性危险特性
遇水、湿空气放出氢气可燃
储运特性
库房通风低温干燥;没于烃中保存; 与氧化剂、卤素、强酸分开存放
灭火剂
干粉、干砂、干石粉
铯
上下游产品信息
上游原料
下游产品