四氢生物蝶呤(tetrahydrobipterin,BH4)是3种一氧化氮合酶的必需辅助因子,包括内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)、神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)。在正常生理状态下,BH4充足的条件下,一氧化氮合酶催化L-精氨酸生成一氧化氮(NO);当四氢生物蝶呤缺乏时,其催化产物是超氧自由基。由于NO具有扩张血管、防止血小板聚集等作用,而BH4直接影响体内NO水平,因此也与心血管系统活动密切相关。四氢生物蝶呤缺乏可能导致内皮功能紊乱、高血压、动脉粥样硬化等一系列心血管活动改变。本文就BH4生物合成、调节及其在心血管疾病中的作用做一综述。
一、四氢生物蝶呤的生物合成
四氢生物蝶呤可来源于从头合成途径,即通过以三磷酸鸟苷(guanosine triphosphate,GTP)为底物的一系列酶促反应途径。Ⅰ型三磷酸鸟苷环化酶(GTP cyclohydrolase Ⅰ,GTPCH)是BH4从头合成的限速酶,能催化GTP形成7,8-三磷酸二氢新蝶呤,然后通过6-丙酮四氢蝶呤合成酶(6-pyruvoyl-tetrahydrobiopterin synthase,PTPS)转化为6-丙酮-5,6,7,8-四氢蝶呤,最后被墨蝶呤还原酶(sepiapterin reductase,SR)还原为BH4。
四氢生物蝶呤还可来源于补救合成途径。在SR的作用下将墨蝶呤转化为7,8-二氢生物蝶呤(7,8-dihydrobipoterin BH2),然后在二氢叶酸还原酶(dihydrofolate reductase,DHFR)作用下转化为BH4。
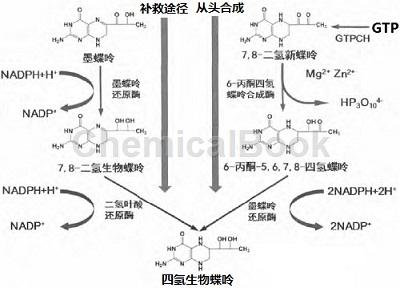
四氢生物蝶呤的再生/回收途径,芳香族氨基酸羟化酶(aromatic amino acid hydroxylase,AAAH)和烷基甘油加单氧酶(alkyl glycerol plus monooxygenase,AGMO)发生催化反应时,BH4被氧化成BH4-4α-甲醇胺,后者经脱水、还原反应再变成BH4,参与催化这2步反应的酶是蝶呤-4α-甲醇胺脱水酶(pterin-4 alpha-methanolamine dehydratase,PCD)和二氢蝶啶还原酶(dihydropterine reductase,DHPR)。在一氧化氮合酶催化反应中BH4再生途径则不需要外源性酶参与,一氧化氮合酶还原结构域提供电子将质子化BH3+还原成BH4[1]。
此外,有文献报道BH4合成还存在外源性途径,但食物中并不存在这种生物蝶呤,近年来肠道微生物作为内源池的一种来源备受关注,肠道微生物中存在能够合成BH4的细菌。Belik等[2]发现可由肠道微生物产生BH4。6-丙酮四氢蝶呤合成酶(6-pyruvoyl-tetrahydrobiopterin synthase,PTPS)是BH4从头合成途径的一种酶,并且其只存在于合成BH4的细菌中并由PTPS-2基因调节。因此PTPS-2可以作为筛选产生BH4的细菌活性标记物。Belik等[2]通过一系列研究发现属于鞭毛藻和微杆菌的放线菌能够产生BH4,因此确定了肠道微生物可以作为BH4生物合成的外源性来源。
二、四氢生物蝶呤与eNOS
四氢生物蝶呤是eNOS必需辅助因子,eNOS与BH4结合形成具有活性的同源二聚体。四氢生物蝶呤具有稳定eNOS结构、稳定eNOS活性二聚体以及增加L-精氨酸与eNOS结合力的作用。在生理条件下,eNOS接受并储存来自烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的电子,在底物L-精氨酸和O2存在时,eNOS将电子转运给L-精氨酸并使后者氧化为L-瓜氨酸并伴随NO形成。当BH4缺乏时,eNOS发生解耦联,即虽然eNOS仍然接受来自NADPH的电子,但是将电子传给O2,使最终产物变成了超氧自由基,而不是NO,结果NO合成减少,最终导致血管内皮功能受损。
三、四氢生物蝶呤与心血管疾病
1.四氢生物蝶呤与血管内皮功能:
血管内皮在维持血管稳态、调节细胞增殖及血管生成、预防血管内血栓形成、介导炎症与免疫反应等方面具有重要作用。血管内皮主要通过一氧化氮合酶生成的NO对维持血管功能起重要作用。四氢生物蝶呤是eNOS的关键调节因子,因此四氢生物蝶呤在血管内皮损伤、增殖、修复、再生中也非常重要。Ali等[3]研究比较了载脂蛋白E(ApoE)基因敲除小鼠内皮特异性过表达GTP环化水解酶Ⅰ(GTP cyclohydrolase Ⅰ,GCHⅠ)与单纯ApoE基因敲除小鼠的差异,发现内皮损伤后,在GCH/ApoE基因敲除小鼠中,内皮祖细胞(endothelial progenitor cells,EPC)数量增加,内皮再生加速,同时生物蝶呤含量增加,而且通过细胞实验揭示在GCH/ApoE基因敲除小鼠体内,发现内皮BH4的增加,增强了移植静脉内皮细胞增殖和生存能力,并增加了EPC水平。这些都表明在内皮损伤后,BH4调节内皮存活和再生,是血管修复和重塑的重要决定因素。同时研究还明确了BH4依赖性的eNOS的调节作为内皮细胞存活、再内皮化和增殖的关键介质,是血管损伤后血管重塑的主要决定因素。维持或增加内皮细胞BH4水平是加速内皮再生和增强血管损伤后再修复的合理治疗靶点。
以往研究表明冠状动脉疾病患者血浆生物蝶呤、炎症和内皮功能之间有着复杂的关系。血浆BH4含量与高敏C反应蛋白(hsCRP)水平相关,但与内皮功能成负相关,但是血管组织中的BH4含量与内皮功能则成正相关[4],口服BH4可以改善内皮功能[5]。Katusic等[6]提出在炎症反应中,血管BH4可能是维持内皮功能的重要保护因素。Rivera等[7]发现,与野生型小鼠相比GTP循环水解酶1缺陷型高苯丙氨酸血症-1(hph-1)小鼠(BH4合成障碍)视网膜中BH4水平较低,且hph-1小鼠表现出一系列形态和功能变化,包括眼球减小、红膜肥厚、胎儿脉管系统持续存在,微血管变性,同时还观察到以小胶质细胞数量增加为特征的炎症反应、促炎因子[包括白细胞介素(IL)-6,IL-1β等]及抗血管生成因子-血小板反应蛋白-1(thrombospondin-1,TSP-1)的增加,补充BH4能够抑制TPS-1的过度抗血管生成活性,并且在高氧条件下能够调节小胶质细胞等引起的炎症反应。研究表明BH4是调节炎症和抗血管生成因子表达的必需辅助因子,并且在维持视网膜微血管系统中发挥重要作用。
2.四氢生物蝶呤与高血压:
全球至少有9.7亿有高血压患者[8]。高血压患者有更多的心血管并发症。目前已经明确,血管eNOS产生的NO在血压调节方面起着重要作用。而BH4是eNOS产生NO的必需辅助因子,因此BH4在血压调节方面也较为关键。Chuaiphichai等[9]发现在敲除GCHⅠ基因的小鼠中,GTPCH蛋白表达下降,BH4含量降低,引起eNOS解耦联,导致内皮功能障碍,使血压升高[9]。此外研究发现通过补充BH4前体墨蝶呤能够增加内皮细胞BH4含量并改善小鼠内皮功能,这与先前的研究结果一致[10,11,12,13]。提示BH4可能通过改善内皮功能而成为高血压治疗的新靶点。
高血压患病率与钠盐平均摄入量呈正相关,摄盐过多将导致盐敏感性患者血压升高。以往研究表明活性氧最初来源于NADPH氧化酶,导致BH4被氧化。BH4治疗阻止eNOS解耦联,并钝化脱氧皮质酮醋酸盐(DOCA)诱导的血压升高[14]。最近研究发现DOCA诱导的高血压小鼠主动脉内皮细胞SR缺乏[15],SR参与BH4的从头合成途径和补救合成途径,表明其在调节NO生物利用度中具有关键作用。更值得关注的是,在细胞培养和小鼠模型中SR过表达增加了BH4含量、NO产生和NO依赖性血管舒张[16],由于SR在DOCA盐诱导的高血压小鼠内皮中的丧失,补充了墨蝶呤对eNOS耦联没有影响,因为不能转换为BH4。但是,联合应用BH4与NADPH氧化酶抑制剂apocynin,就能完全恢复NO生物利用度[15],从而改善内皮功能。说明BH4能够改善高血压内皮功能紊乱[17],增加正常血压和高血压患者内皮依赖性的血管舒张。同样显示了BH4在高血压治疗中的巨大潜力。
3.四氢生物蝶呤与动脉粥样硬化:
内皮功能紊乱是动脉粥样硬化等心血管疾病的始动环节。Miller等[18]通过高胆固醇饲养小鼠6和12个月,发现BH4从头合成途径的限速酶GTPCH表达增加。这一结果与先前ApoE基因敲除小鼠的结果一致。在5个月高脂饮食后,GTPCH表达及其活性显著增加,使血管中BH4水平增加[19]。同时研究者还观察到,墨蝶呤孵育的血管对乙酰胆碱诱导的血管舒张反应并没有改善,但是高脂饮食12个月后给予墨蝶呤治疗能够改善内皮依赖性血管舒张。这些结果与BH4对高胆固醇饮食的治疗效果是一致的。BH4能够降低eNOS解耦联,降低氧化应激及减轻炎症反应,改善内皮功能。已有研究表明增加BH4含量也可以改善动脉粥样硬化患者内皮功能[20]。因此BH4也可能成为治疗动脉粥样硬化患者内皮功能紊乱的新型治疗靶点。
最近Park等[21]研究表明慢性肾脏疾病患者接受12周BH4治疗后,患者的增益指数(augmentation index,AIx)、脉搏波传导速度(pulse wave velocity,PWV)、血流介导的血管舒张功能(flow-mediated diameter,FMD)及血压均明显改善[21]。Porkert等[13]研究表明高血压患者接受400 mg BH4治疗8周后,血压明显降低。但Mäki-Petäjä等[22]关于急性类风性湿关节炎(rheumatoid arthritis,RA)患者的研究表明,急性及短期(1周)给予BH4治疗后能改善内皮功能,但不能改善AIx、PWV、FMD和血压。BH4治疗能改善内皮功能,若长期坚持,BH4也可能成为动脉粥样硬化治疗的一个新靶点。
4.四氢生物蝶呤与心肌细胞保护:
先进的放射治疗技术给许多疾病带来了福音,如恶性肿瘤、心血管疾病等[23],但同时也引起了许多并发症,如心血管并发症、内分泌失调、心肺功能障碍等[24]。其中辐射诱发的心脏疾病(radiation-induced heart disease,RIHD)是较严重的并发症之一。最近研究表明接受放射治疗的患者发生心肌病的风险较大,增加了心肌梗死和心衰的风险[25]。辐射可使细胞和组织产生过多的活性氧,从而导致氧化应激。氧化应激在辐射诱发的心肌损伤中起着关键作用。已有研究证明BH4可改善糖尿病大鼠动脉中的氧化应激水平[26]。Zhang等[27]研究表明,辐射可显著增加细胞内丙二醛(malondialdehyde,MDA)水平、降低过氧化物歧化酶(superoxide dismutase,SOD)含量,而在辐射损伤的H9C2细胞中,BH4治疗显著增加SOD含量,阻断了MDA的产生,说明BH4防止H9C2细胞中X线辐射诱导的氧化应激。并且此研究还发现BH4可逆转细胞周期中细胞死亡、凋亡等过程诱发的心肌损伤,P13K/Akt信号通路可能参与了X射线辐射诱导的生长抑制和BH4治疗对放射诱导的心肌细胞损伤的保护作用。四氢生物蝶呤在治疗心肌细胞损伤中的前景值得期待。
5.四氢生物蝶呤与肺动脉高压:
肺动脉高压是一种以肺动脉血管收缩和血管重塑为特征的破坏性疾病。eNOS对维持正常肺血管张力及结构具有重要作用。功能障碍的eNOS可以使肺血管系统中的NO和超氧化物不平衡,有助于肺动脉高压的形成。BH4是调节eNOS活性的必需辅助因子,BH4稳定eNOS的二聚体,促进电子转移,并使NO生成与超氧化物的产生达到平衡。近来研究显示BH4与肺动脉高压有关[28]。BH4含量低与肺动脉和全身血压升高有关,补充BH4可以促进血管舒张、降低全身血压[29]。在hph-1小鼠中观察到,BH4缺乏在小鼠出生时引起肺动脉高压。GTPCH-1突变的hph-1小鼠的肺血管阻力增加的机制可能涉及肺中过氧亚硝酸盐积累增加,eNOS解耦联,后者诱导肺血管重建。Francis等[30]在分离灌注肺中观察到,外源性给予BH4对肺NO产生具有直接作用,可使缺氧诱导的肺血管收缩期间发生急性血管舒张。BH4的作用是剂量依赖型的。在慢性缺氧诱导的肺动脉高压的大鼠模型中,BH4以100 mg·kg-1·d-1口服给药,有效降低了肺动脉压、右心室肥厚、肺血管重构,而10 mg·kg-1·d-1则未见明显变化。研究表明BH4在低氧大鼠模型中有效逆转了肺动脉高压。BH4对肺动脉高压患者临床安全性研究也显示出积极的作用,其中BH4治疗剂量为5 mg·kg-1·d-1能够增加6 min步行距离,并且血浆单核细胞趋化蛋白水平下降[31]。研究显示出了BH4治疗肺动脉高压的潜力。
6.四氢生物蝶呤与阻塞性呼吸暂停低通气综合征(OSA):
OSA是心血管疾病的危险因素之一。OSA引起心血管疾病的机制并未完全阐明。研究证实在OSA发展为高血压之前,最早出现的是内皮功能紊乱[32]。研究发现BH4生物利用度降低使OSA患者eNOS解耦联,后者可能是潜在的药理学靶向治疗点,并可由此来减低OSA患者心血管疾病的风险,未来需要更多的研究探讨BH4的靶向治疗作用[33]。
综上所述,四氢生物蝶呤是许多代谢性疾病发生、发展的重要调节因子。目前研究表明,四氢生物蝶呤在调节eNOS生成NO和过氧化物的平衡中具有重要作用。许多证据表明四氢生物蝶呤与血管内皮功能紊乱、高血压、动脉粥样硬化等疾病密切相关,但由于四氢生物蝶呤易被氧化、不稳定,限制了其在临床上的应用。肠道微生物能够产生四氢生物蝶呤,未来或许可以通过微生物移植来解决BH4的不稳定问题,但这仍需更多深入研究。期待干扰BH4代谢途径的思路能为相关疾病的治疗带来新的方法。
