1,2,3-三氮唑是有机合成和药物化学中最为常见的一种杂环骨架。近年来研究表明,N1-位上带有吸电子基团(如苯磺酰基)的1,2,3-三氮唑容易发生Dimorth重排反应,形成以开环形式存在的α-亚胺重氮化合物。1,2,3-三氮唑这一独特的反应性使其可以作为α-亚胺重氮化合物的等价物,参与各类金属卡宾介导的环加成反应或环化反应(图1A)。与此不同的是苯并三氮唑作为一种芳香杂环,其化学性质非常稳定,常作为一种辅助基应用于各类有机合成反应。研究表明,该类杂环中的三氮唑结构单元只有在非常苛刻的反应条件下(如高温热解或光照)才能发生开环反应,形成相应的邻氨基重氮化合物。因此,如何在较为温和的条件下活化苯并三氮唑,进而使其以开环形式(邻氨基重氮盐)参与化学反应,仍然是一项具有挑战性的研究任务。
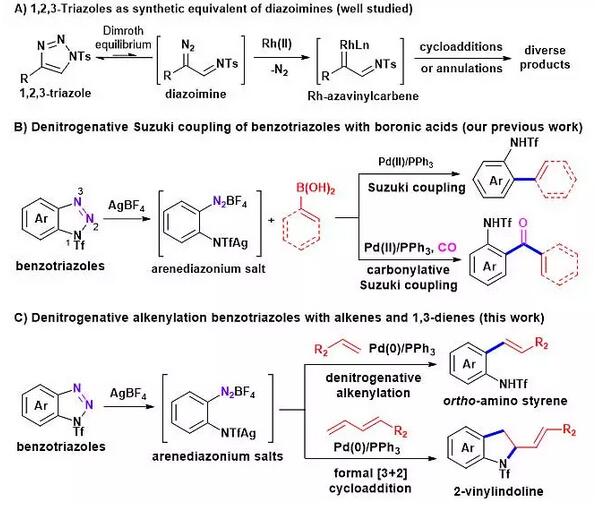
图1. 苯并三氮唑作为邻氨基芳基重氮盐等价物在偶联反应和环加成反应中的应用
近来,清华大学药学院唐叶峰教授课题组设计了一种新颖的“活化+稳定”双管齐下的策略,即通过在苯并三氮唑N1-位引入强吸电子基团来活化N1-N2单键,同时使用AgBF4稳定苯并三氮唑开环后形成的重氮盐中间体,从而成功实现苯并三氮唑在温和条件下的开环反应,并将其产生的邻氨基重氮盐作为活性中间体应用于一系列过渡金属催化的偶联反应或环加成反应。2017年初,该课题组首先报道了苯并三氮唑和硼酸之间的脱氮气Suzuki偶联反应与羰基插入的Suzuki偶联反应(图1B)(Chem. Sci., 2017, 8, 3852-3857)。基于相同的理念,该课题组最近又成功实现了钯催化的苯并三氮唑和烯烃之间的烯基化反应以及同1,3-共轭二烯之间的形式[3+2]环加成反应(图1C)(Chem. Commun., 2017, 53, 11873-11876)。上述新型有机反应能够快速构建多取代邻氨基苯乙烯和2-烯基二氢吲哚等重要结构单元,在有机合成和药物化学中具有良好的应用前景。
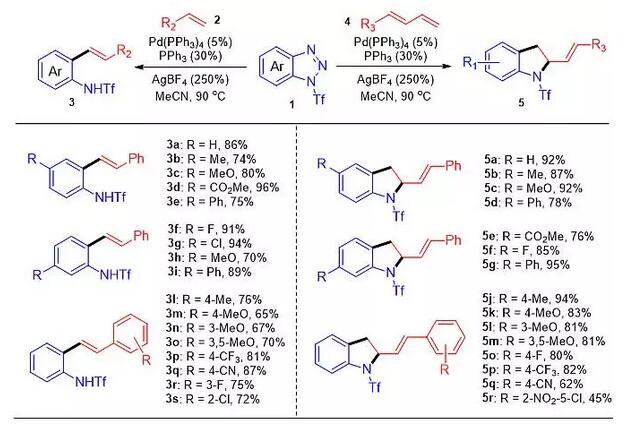
图2. 苯并三氮唑和烯烃之间的偶联反应或环加成反应的底物普适性
研究表明,苯并三氮唑与烯烃之间的偶联反应可以通过两种不同的途径进行。当使用一般的末端烯烃为底物时,主要发生Heck-类型的脱氮气偶联反应,得到邻氨基苯乙烯衍生物。在此过程中,苯并三氮唑作为[1C]-合成子参与偶联反应。而同样的反应条件下使用1,3-丁二烯作为反应物,则主要发生形式上的[3+2]-环加成反应,得到相应的二氢吲哚衍生物。在这一反应中,苯并三氮唑可以被认为是一个氮杂[3C]-合成子。作者通过计算化学研究,对于上述反应的选择性进行了合理的解释。从理论上讲,无论是简单烯烃还是1,3-丁二烯,在发生双键插入反应之后,都有两种可能的反应途径,即发生β-H消除形成的苯乙烯衍生物或发生C-N键形成得到二氢吲哚衍生物。DFT计算的结果表明,当使用简单烯烃时,发生β-H消除的活化能比相应的[3+2]环化过程要低,因此优先生成Heck类型产物。相反,当使用1,3-丁二烯时,反应中形成的π-烯丙基钯物种具有高亲电性,使得该途径下的β-H消除变得难以发生,取而代之的是发生分子内的N烷基化,得到二氢吲哚衍生物(图 3)。
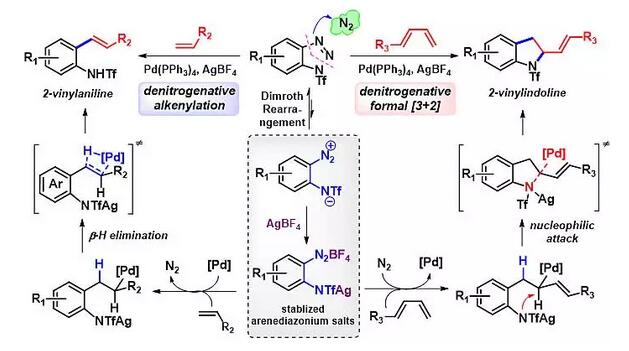
图3. 苯并三氮唑和烯烃之间的偶联反应或环加成反应的机理推测
上述研究工作表明,传统观点中非常稳定的苯并三氮唑可在较为温和的条件下发生开环反应得到邻氨基芳基重氮盐,该中间体既可以用作[1C]-合成子参与过渡金属催化的偶联反应,也可以作为氮杂[3C]-合成子参与环加成反应。值得一提的是,邻氨基芳基重氮盐作为一种非常有用的有机合成中间体,目前尚无其它有效方法获取。因此,本项工作不仅大大丰富了苯并三氮唑的反应性,而且由于其具备原料易得、反应条件温和、反应高效和选择性好等特点,在有机合成和药物化学中具有广阔的应用前景。
参考文献
Chem. Commun., 2017, 53, 11873-11876, DOI: 10.1039/C7CC07543J
