背景及概述[1]
盐酸托烷司琼是强效选择性5HT3受体拮抗剂,由诺华公司研制开发,1992年在英国上市,商品名为Navoban,用于预防和治疗放疗化疗引起的恶心、呕吐。该药已在全球数十个国家上市,目前其适应症还扩大到预防和治疗儿童放化疗恶心、呕吐预防和治疗成人术后恶心呕吐,盐酸托烷司琼的特点是具有疗效确切,耐受性好,不良反应小等优点且使用十分方便;只需在放化疗前缓慢静注或是输注。

制备[2-3]
报道一、
(1)吲哚‑2‑甲酰氯的制备:
于500mL三口瓶内加入20.0g吲哚‑3‑甲酸、300mL1,2‑二氯乙烷和3mLDMF,搅拌下缓慢滴加20mL氯化亚砜,45℃反应8h,蒸除多余的氯化亚砜和1,2‑二氯乙烷,加入100mL四氢呋喃溶解备用。
(2)α‑托品醇钠的制备:
于500mL三口瓶内加入19.0gα‑托品醇、100mL四氢呋喃和5.4gNaOH固体,室温下搅拌反应4h,备用。
(3)盐酸托烷司琼的制备:
室温下将吲哚‑3‑甲酰氯的THF溶液缓慢滴加至托品醇钠的THF溶液中,35℃搅拌反应过夜,减压蒸馏回收THF,用95%乙醇重结晶,得淡黄色固体,加入70mL无水乙醇,加热溶解,冷却后通入HCl气体,室温搅拌反应30min,抽滤,得盐酸托烷司琼粗品。无水乙醇重结晶,得白色结晶性产品21.2g(液相色谱测定纯度为99.91%),总收率为53.29%,熔点为283~285℃,产品的光谱与文献报道的一致。
报道二、
以吲哚-3-甲酸(1)为原料,在惰性溶剂中与草酰氯或者二氯亚砜反应制得吲哚-3-甲酰氯(2),再与经正丁基锂活化的α-托品醇缩合成酯,得到托烷司琼,最后与HCl成盐得到盐酸托烷司琼(对比工艺路线如图3所示)。该路线中用到了价格昂贵的草酰氯,同时也用到了价格昂贵且危险试剂正丁基锂,给工业化安全生产带来隐患,而且反应条件比较苛刻,不易控制。反应瓶中依次加入原料1(50g,0.3mol)、甲苯400ml及二氯亚砜(62ml,0.85mol)搅拌回流反应2h,反应完全后常压蒸出溶剂甲苯及多余的二氯亚砜,蒸毕,降温至50℃下缓慢加入溶有托品醇(50g,0.36mol)的甲苯溶液200ml,升温至80℃搅拌反应3h。反应结束后,减压蒸除甲苯,冷却至10℃以下,加入500ml乙酸乙酯和500ml水搅拌,滴加氨水调节PH约为10,静置分液,分去水层,有机层用水500ml洗涤至中性,无水硫酸钠干燥,过滤,滤液减压浓缩蒸去乙酸乙酯,剩余物加入无水乙醇(200ml)溶解,控温45℃以下,通入HCl气体至PH≈3为止,再加入少量活性炭脱色,过滤,滤液浓缩至有大量固体析出,冷却,冰箱放置,过滤得粗品30g,总收率30%;
制剂[4-6]
注射液的制备:
盐酸托烷司琼注射液的处方
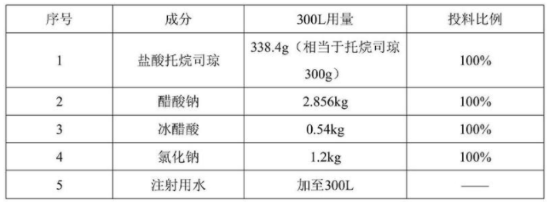
制备方法:
(1)配料罐、玻璃棒、烧杯、硼硅玻璃安瓿瓶洗净并灭菌处理;
(2)按处方量称取盐酸托烷司琼、醋酸钠、冰醋酸和氯化钠。配料罐中加入配制量80%的注射用水,水温控制在70℃。
(3)依次投入处方量的醋酸钠、冰醋酸和氯化钠,搅拌10min使溶解,再投入盐酸托烷司琼,搅拌20min使溶解,补充注射用水至全量,过0.45μm和0.22μm滤芯,循环搅拌20分钟之后,取样半成品进行检测。
(4)半成品检验合格后用0.22μm的微孔滤器精滤至可见异物符合规定。
(5)灌封于按常规工艺洗净的5ml中硼硅玻璃安瓿中。121℃灭菌15分钟。
(6)灯检,剔除不合格品,将合格品包装。
口服液的制备:
一种盐酸托烷司琼口服液的制备方法,称取盐酸托烷司琼、枸橼 酸、枸橼酸钠、甜菊、注射用水。
(1)称量原辅料,将4/5注射用水加入配料罐中,冷却至40±5℃;
(2)将盐酸托烷司琼、枸橼酸、枸橼酸钠、甜菊素依次加入配料罐溶解,每加 完一种原辅料后用200ml的注射用水冲洗容器,将清洗水倒入配料罐内;
(3)加入剩余处方量的注射用水,回流15分钟;
(4)取样测PH值及含量,用HCL或NaOH调节PH值至4.5;
(5)将消毒后洁净的滤器、滤膜安装好,将药液滤入缓冲瓶;
(6)检查澄明度,合格后灌装,然后开启网带机及灌封机,进行送瓶及灌封, 置供试品于灯检台遮光板边缘处,距眼25cm,分别在黑色和白色背景下,手持供试 品颈部轻轻旋转和翻转容器使药液中存在的可见异物悬浮,用目检视。判断标准: 不得有发霉、变色、浑浊、金属屑、长度超过1cm纤毛和块状物等明显可见的异物, 并在旋转时不得检出烟雾状微粒柱,小于1cm的纤毛、白点或细小颗粒不得多于3 个/支;
(7)将灌封好的托烷司琼口服溶液半成品倒置放入灭菌柜中灭菌,灭菌工艺参 数为:灭菌温度115℃,真空3次,灭菌30分钟,干燥8分钟进行灭菌;
(8)灯检,开启灯检机,按规定对其进行检查,剔除破损及装量不合格者、霉 变、浑浊及含有异物者、压盖不严及其他异常情况者。
冻干粉针的制备:
(1)量取1500mL的注射用水加入配料配制容器中,依次加入甘露醇30g、枸橼酸1g、枸橼酸钠2.6g、氯化钠0.5g,搅拌至完全溶解,降温至25℃以下;
(2)加入盐酸托烷司琼5.64g,搅拌至完全溶解,测试其pH为4.8;
(3)除菌过滤后进行灌装,灌装体积为2mL;
(4)将药品装入冻干机进行预冻-42℃,维持1h,升介质-5℃,用1h升到后维持12h,升介质40℃,维持3.5h,干燥结束停机,通无菌氮气,压塞;
(5)轧盖、包装,全检,入库。
参考文献
[1][中国发明]CN201911066731.5盐酸托烷司琼的制备方法
[2][中国发明]CN201110007453.3一种规模化制备盐酸托烷司琼的方法
[3] [中国发明] CN201510877018.4 一种盐酸托烷司琼的制备方法
[4] CN202011638850.6一种盐酸托烷司琼注射液的配方及制备方法
[5] [中国发明] CN201410023054.X 一种盐酸托烷司琼口服液的制备方法
[6] [中国发明,中国发明授权] CN201510483309.5 注射用盐酸托烷司琼冻干粉针及其制备方法
