背景及概述[1]
叔丁氧羰基-L-鸟氨酸可用于保护L-鸟氨酸,避免副反应的进行。
保护氨基酸是合成多肽最基本的原料,为了避免副反应的进行,要事先把不需反应的氨基进行保护,使它们在合成过程中不参与反应,从而避免副产物的生成。近年来,鸟氨酸在生理、药理、医学上的研究取得了很大的进展,可用于制备治疗肝病、抗疲劳、抗虚弱等各种复方氨基酸输液,其衍生物还经常用以制备活性肽以及某些多肽药物,这使得保护鸟氨酸的研究对于活性多肽分子的设计与化学合成有着重要的意义。
制备 [1]
以L_鸟氨酸盐酸盐为原料,经碱式碳酸铜配合α-氨基,在氨基上引入苄氧羰基(z),用乙二胺四乙酸二钠盐(EDTΑ-2Nα)脱去铜离子,得到N-苄氧羰基鸟氨酸,再在α-氨基引入保护基叔丁氧羰基(Boo),得到苄氧羰基-N-叔丁氧羰基-L-鸟氨酸,再选择性脱去苄氧羰基,得到叔丁氧羰基-L-鸟氨酸。
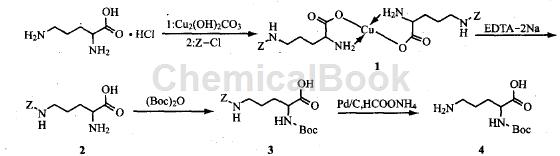
步骤1: N 苄氧羰基-L-鸟氨酸铜配合物(1)的合成
将16.8 g(0.1 mo1)L-鸟氨酸盐酸盐、.11.0 g(0.05 mo1)碱式碳酸铜和100 mL水混合,回流反应2 h,冷却,过滤除去不溶物-0~5℃ 向上述滤液中缓慢滴加溶于50 mL丙酮的8.5 g(0.05 mo1)氯甲酸苄酯,用10 9/6(质量分数)NaHCO3溶液维持反应液pH 9,加毕后,升至室温反应6h,过滤,滤饼用水、丙酮洗涤,得蓝色固体24.7 g,收率82.8%(以L_鸟氨酸盐酸盐计)。
步骤2: N-苄氧羰基-L-鸟氨酸(2)的合成
将11.9 g0.02 mo1)化合物1悬浮于120 mL水中,加7.5g(0.02mo1)EDTΑ-2Na,80℃反应2h,过滤,滤饼用乙醇一水重结晶后,得白色固体4。
步骤3: N -苄氧羰基-叔丁氧羰基-L-鸟氨酸(3)的合成
将26.6 g(0.1 mol)化合物2溶解于600 mL叔丁醇/水(1:1),用2 mol/L Nα0H 调至pH 9,分批加入21.8 g(0.1 mol)(Boc)20,控制反应液pH 9。加毕,继续在冰水浴中搅拌2 h,40 oC反应12 h。反应完毕后,反应液用乙醚萃取三次(30 mLx 3),以除去未反应的(Boc)2O,水相在冰水浴充分冷却,用1 mol/L柠檬酸将溶液调pH 2~3,再分别用乙酸乙酯萃取三次(30 mL×3),减压浓缩,将浓缩物用乙酸乙酯重结晶,得白色固体30.7 g,收率83.8%(以化合物2 计)。
步骤4:叔丁氧羰基-L-鸟氨酸(4)的合成
将36.6 g(0.1 mol)化合物3溶解于300 mL甲醇,加入25.2 g(0.4 mol)甲酸铵与3.66 g 10% Pd/C催化剂,25℃反应3 h,过滤,滤液经离子交换树脂(Αmberlit IRΑ-410离子交换树脂,甲醇洗脱),减压浓缩,得白色固体20.0 g,收率86.2% (以化合物3计)。
主要参考资料
[1] 张玲, 陈曦, 贾根光, 等. N-保护鸟氨酸的合成[J]. 化学世界, 2011, 52(4): 239-243.
