华中农业大学动物科学技术学院、动物医学院晏向华教授课题组揭示了亮氨酸调控mTORC1通路的机制,为营养物质尤其是亮氨酸调控mTORC1的机制提供了理论依据。相关研究成果以“KAT7-mediated CANX (calnexin) crotonylation regulates leucine-stimulated MTORC1 activity”为题在Autophagy发表。
mTORC1作为机体感应营养物质尤其是氨基酸最重要的信号通路之一,通过其激酶活性磷酸化不同底物,参与多种下游的生理及病理过程。氨基酸通过调控mTORC1的溶酶体定位进而影响其激活过程,迄今为止已有多个重要的调控蛋白或蛋白复合体在溶酶体表面调节mTORC1的溶酶体移位,但是否还有新的调控蛋白参与此过程仍旧未知。晏向华课题组在前期成功构建了受亮氨酸调节的mTORC1激活过程中的体外无细胞体系。
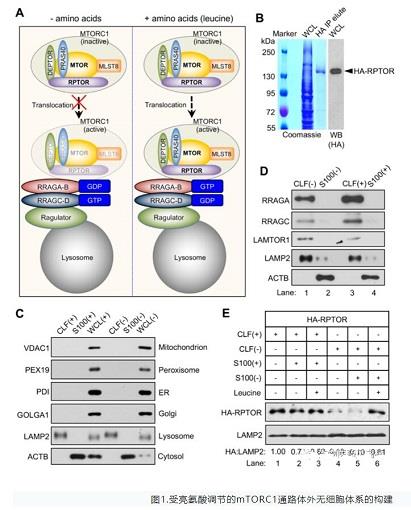
图1.受亮氨酸调节的mTORC1通路体外无细胞体系的构建
在体外无细胞体系的基础上,研究人员在整体蛋白质组范围内大规模地分析了亮氨酸调控的溶酶体移位的蛋白质。试验成功鉴定到已被报道的亮氨酸感受体蛋白SESN2,在此基础上,发现钙调蛋白Calnexin可能在亮氨酸缺失后移位至溶酶体组分。研究团队在后续综合运用基因编辑、亚细胞分离、免疫荧光等实验,确认了Calnexin参与亮氨酸调控mTORC1激活的过程,并揭示了亮氨酸缺失后Calnexin移位至溶酶体表面与溶酶体膜蛋白LAMP2结合的机理。结合课题组前期的一项巴豆酰化比较蛋白质组的结果,研究团队发现并证明了乙酰转移酶KAT7能够催化Calnexin的巴豆酰化修饰,进而调节Calnexin的溶酶体移位过程。最后与已知的mTORC1调控蛋白进行关联分析,发现移位至溶酶体表面的Calnexin抑制了Ragulator复合体对Rag GTPase的GEF活性进而抑制了mTORC1的溶酶体移位。
此外,该研究鉴定到了多个亮氨酸调控mTORC1过程中的新调控蛋白,并首次证明了新型蛋白质Calnexin翻译后修饰-赖氨酸巴豆酰化修饰-参与调控mTORC1的活性。
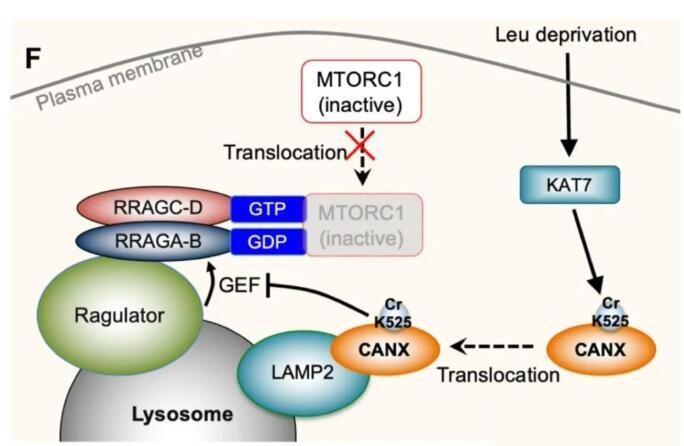
图2. KAT7介导的CANX巴豆酰化调控mTORC1的机制
