背景及概述[1][2]
莪术为姜科植物蓬莪术(Curcumaphaeocaulisval.)广西莪术和温郁金的干燥根茎。中医理论认为,莪术味辛、苦、温,归肝、脾经,具有行气破血、消积止痛的功效,用于治疗瘀血经闭、食积胀痛、症瘕痞块等;还具有抗早孕、抗凝血、抗氧化和保肝等作用。
莪术中富含挥发油,且成分相当复杂,主要为倍半萜和倍半萜烯类化合物。经研究发现,莪术的提取物———莪术挥发油,有较好的抗肿瘤、抗炎、抗病毒作用。莪术挥发油中抗肿瘤活性成分主要为β-榄香烯、莪术醇、莪术酮、莪术二酮和异莪术醇等。莪术挥发油还具有保肝、抗菌、升高血细胞、抗栓塞、增加胃肠运动等药理作用。
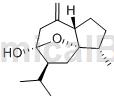
莪术醇(curcumol)又名姜黄环奥醇,为具有半缩酮的氢化奥类化合物,由五元环和六元环并合而成,其中的七元环通过半缩酮的氧桥,又形成了一个五元环和六元环,因而使得三个环的张力变小,形成了具有刚性结构的较稳定的化合物。莪术挥发油中另一成分莪二酮,在加热或路易斯酸的催化下,可以定量地异构为莪术醇,就是由不稳定的状态转变为比较稳定的状态。莪术醇为无色针状结晶,其熔点为142 ~ 147 ℃,比旋度(α)为40.8 ℃,折光率n25为1.482。
在加热条件下可结晶为棒状,并发生升华现象。无紫外吸收,无荧光发生。易溶于乙醚、氯仿,溶于乙醇,微溶于石油醚,几乎不溶于水,在水中溶解度仅为0.3%。莪术醇是莪术挥发油抗癌、抗病毒、抗菌等作用的有效成分之一,莪术油制剂被我国1977版药典收藏为抗癌药物,被1995版、2000版、2005版药典收藏为抗病毒药。
结构
药理作用[2]
1. 抗肿瘤作用
早在20 世纪70 年代,我国科研工作者研究表明,莪术醇皮下注射对小鼠肉瘤S37、宫颈癌U14、艾氏腹水癌均有明显的抑制作用。其抗癌机制可能是与抑制肿瘤细胞的核代谢、增强机体的特异性免疫、产生明显的免疫保护作用有关。莪术醇能抑制肿瘤细胞生长及RNA的合成。莪术醇对13 种妇科肿瘤细胞和2 种正常乳腺细胞生长有抑制作用并能阻止DNA的合成。
同时,莪术醇-MFC细胞瘤苗在体外能有效诱导荷瘤胃癌的小鼠免疫细胞活化增殖和特异性细胞毒T淋巴细胞(CTL)活性的产生,在体内能降低成瘤能力。莪术醇构建的SGC-7901瘤苗能显著抑制荷瘤胃癌的小鼠皮下肿瘤结节形成,明显阻止胃癌细胞的肺转移,延长荷瘤鼠的生存时间。对13 例胃肿瘤患者实体瘤术后应用自体瘤苗治疗,其生存质量及疗效明显优于治疗前及对照组。
这提示莪术醇生物瘤苗可能会是一种实用的辅助治疗方法。莪术醇能时间-剂量依赖性地抑制L1210 细胞生长,且其抑制作用比莪术油更强。莪术醇处理后,细胞形态发生改变,形成特征性的凋亡小体。这提示其通过诱导细胞凋亡抑制L1210 细胞生长。此外,莪术醇能明显抑制体外培养的HepG2 细胞生长,并可诱导其凋亡,其机制可能是抑制COX-2和VEGF基因表达。因此,诱导凋亡可能是其抗肿瘤作用的重要机制之一。
2. 其他药理作用
基因芯片技术研究发现,莪术醇可降低肝星状细胞转化生长因子β1、细胞色素P450a表达,提示其抗肝纤维化的潜能。在激素加肾上腺素制作的大鼠血瘀模型中,莪术醇显示出一定的抗血栓作用。此外,莪术醇还具有较明显的抗生育作用,用于作饵剂,降低雌鼠繁殖率和平均胎仔数,以防控农田鼠害。
药动学[2]
莪术醇在大鼠的胃肠道吸收迅速且完全,灌胃后5 min 中可检出,15 min 达高峰,生物半衰期为11.5 h(t1/2β)。静脉注射后分快、慢两相,生物半衰期分别为33 min(t1/2α)及12.5 h(t1/β)。组织中浓度与血浆浓度略成平行关系。肝及肾组织含量较高,主要自尿排泄,口服或静脉注射后24 h 分别自大鼠尿排出剂量的45.38%及51.91%。胆汁为另一排泄途径,大鼠口服或静脉注射后24 h,分别自胆汁排出36.47%及56.43%,肝肠循环明显,并可通过血脑屏障。在正常大鼠体内分布情况与肿瘤小鼠相似,肿瘤组织中的分布与其它组织无明显差别。
在Beagle 犬中静脉推注不同剂量莪术油脂肪乳剂后,其中的莪术醇的代谢过程基本符合三室模型,主要药动学参数AUC呈明显剂量相关性,半衰期较大鼠短,在体内清除较快,且血管外分布较广。
毒性[2]
小鼠腹腔注射莪术醇的半数致死浓度(LD50)为250 mg·kg-1,7 d 连续腹腔注射的亚急性LD50为163.4 mg·kg-1。莪术醇对大鼠慢性毒性靶器官为肝、肾脏和卵巢。6个月慢性经口阈剂量雌、雄大鼠均为290 mg·kg-1,无作用剂量雌、雄大鼠均为290 mg·kg-1。
结构修饰与生物转化[2]
近年来,对莪术醇进行结构修饰和生物转化的研究较多。用微紫青霉生物转化莪术醇,得到15-羟基莪术醇。该转化产物对副流感病毒、呼吸道合孢病毒和单纯疱疹病毒Ⅰ型具有较好的抑制作用。采用荨麻青霉进行微生物转化,得到3-α-羟基莪术醇和11-R-12-羟基莪术醇。
利用微生物黑曲霉进行生物转化,得到3β-羟基莪术醇。该转化产物在体内、外有较好的抑制作用。对莪术醇C6上的羟基进行酯化和烷基化反应,得到了一系列莪术醇衍生对莪术醇C6位羟基进行糖苷化修饰,合成了一系列莪术醇糖苷类化合物,提高了水溶性和体内运转能力。体外实验显示这些糖苷化衍生物肿瘤细胞具有一定的杀伤作用。
提取分离[3]
莪术醇(Crucumol)亦称姜黄醇,为无色针状结晶,在加热条件下可变为棒状,并发生升华现象。取温郁金饮片,用五倍量的水浸泡12 h,然后水蒸汽蒸馏,放置使析出结晶,过滤,以石油醚(沸程30 ~60℃)充分洗涤结晶,再用无水乙醇重结晶即得莪术醇针状结晶。取温郁金饮片经上述方法不断地析出结晶,所得结晶为莪术醇和莪术二酮的结晶混合物,经硅胶柱层析,石油醚-乙醚(9∶1)洗脱,将两者分开后,再以无水乙醇重结晶得到莪术醇。
1)传统提取方法:传统的莪术醇提取技术是利用水蒸汽蒸馏法(SD)或索氏萃取法(SX)从莪术中提取挥发油。取莪术药材粉碎成粗粉,称量270 g,加入1000 ml烧杯中,加水约500 ml,加入沸石,连接冷凝管及挥发油提取器,加热提取5 h,得挥发油,提取率分别在0.2% ~ 0.35%之间。用SD法提取莪术挥发油,通过正交试验设计法优选获取莪术挥发油的技术参数,结果表明以药材粗粉为原料,按药材∶水=1∶8蒸馏8 h,药材出油得率平均可达2.51%。
取干燥莪术粉末(过60 目筛),采用SD法提取挥发油。按L9(34 )正交试验,以SD法提取挥发油,优选出莪术挥发油提取的工艺条件:莪术粒度为20~ 40目,蒸馏时间为8 h,不浸泡。通过多种提取分离方法比较,得出较优的方法:用甲醇提取温莪术干粉,减压蒸去甲醇,适量水稀释,石油提取,蒸去溶剂即可得挥发油。
2)现代提取方法 超临界流体萃取技术(SFE)是近年来发展起来的新型分离技术,近年来,SFE被广泛用于药物有效成分的提取分离。采用SD、SX、SEF等方法探讨莪术挥发油提取的技术,结果表明:SEF萃取莪术较传统的萃取能力强,萃取效率高,有利于提高产品收率和资源利用率,而且提取时间短、能耗低,还可避免使用大量有机溶剂,减少污染。
采用SD、SX和SFE三种方法提取蓬莪术挥发油,并利用GC-MS联用仪分析比较其化学成分差异,结果SD萃取法得油率为2.2%,SX萃取法得油率为2.0%,而SFE萃取法得油率为2.4%~ 2.8%,SFE萃取法明显优于SD和SX萃取方法,非常适合中药现代化产业的发展及人类对环境的保护。
主要参考资料
[1] 莪术醇抗肿瘤研究进展
[2] 莪术醇的研究进展
[3] 莪术醇的研究进展
