一、抗体亲和纯化
抗体亲和纯化是基于抗原 - 抗体、抗体 - 配体(如 Protein A/G/L)特异性相互作用的高效纯化技术,核心优势是高纯度(单次纯化可达 95% 以上)、高收率、操作简便,广泛应用于单克隆抗体、多克隆抗体、抗体片段(Fab/scFv)的实验室制备与工业生产。
为了最大限度地纯化IgG,可利用高容量IgG结合特异性细菌蛋白固定在固相载体上,如琼脂糖凝胶或琼脂糖磁珠。用于纯化抗体的细菌蛋白,如(1)来自金黄色葡萄球菌的Protein A,(2)来自链球菌的Protein G,(3)来自大胃链球菌的Protein L。每一种蛋白都具有独特的Ig结合特性,如表1所示,可用于从各种基质如血清、培养上清液或腹水中纯化抗体。
表1 protein A, protein G, and protein L的抗体结合特性
Recombinant protein-A/protein-G
G. Streptococcus sp.、C. Streptococcus sp.
Staphylococcus aureus、Streptococcus sp.
Peptostreptococcus magnus
65,000 G148 protein-G 40000 G43 protein-G 58,000 C40 protein-G
表2 protein A, protein G, and protein L对不同种属抗体的相对亲和能力
二、“四大名捕”的前世今生
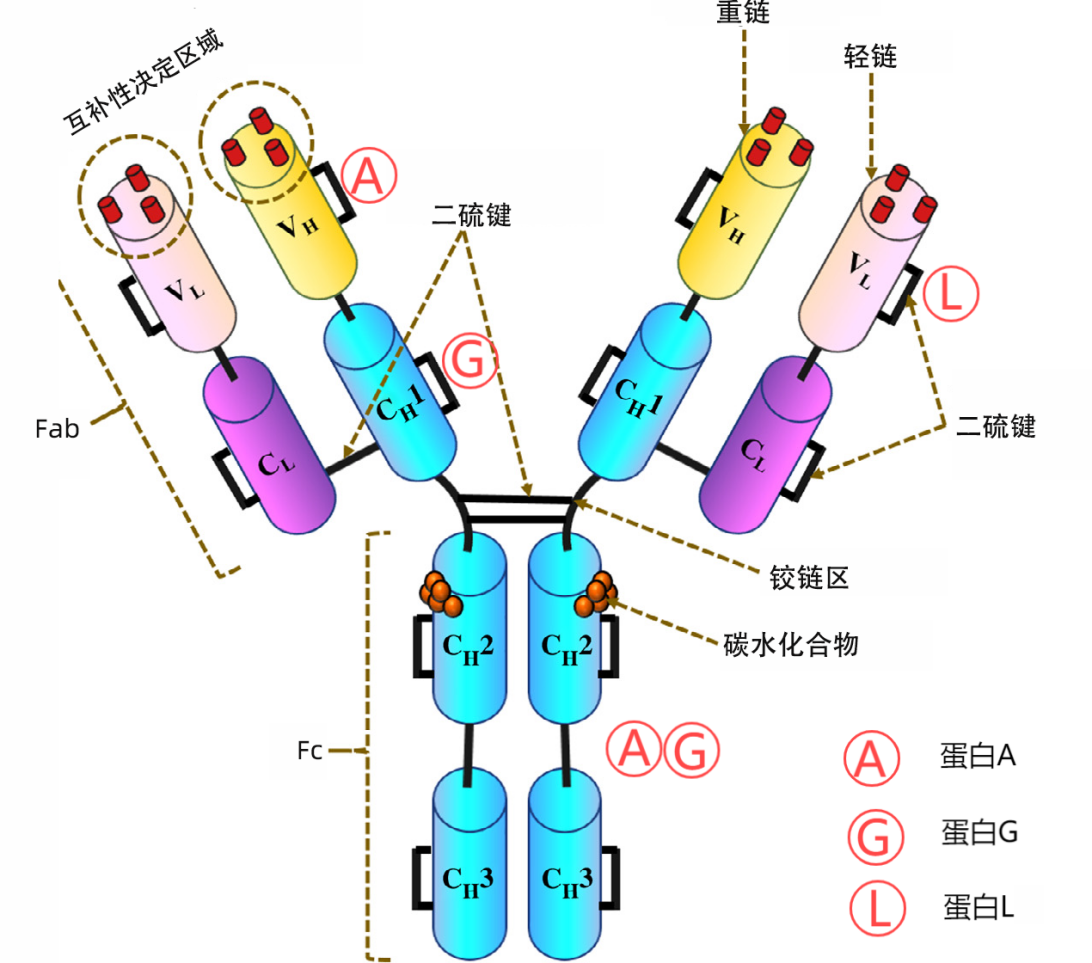
图3 抗体与抗体亲和配基的作用区域
1. Protein A: Fc段特异性结合的“经典工具”
(1)基础特性:Protein A由一种从原核生物金黄色葡萄球菌细胞壁分离的结合受体,分子量约 56kDa,无半胱氨酸和色氨酸,几乎不含糖。天然状态下通过共价键连接于细菌胞壁肽聚糖,重组型常被改造以优化性能。
(2)结构特点:核心结构包含 E、D、A、B、C 这 5 个高度同源的 IgG 结合域,每个结构域约含 58 个氨基酸,折叠形成三螺旋束的三维结构。此外还有一个 C 端细胞壁锚定结构域,负责与细菌细胞壁结合。这种结构使其能稳定结合免疫球蛋白的特定区域。
(3)结合特性:主要结合多数免疫球蛋白 Fc 区的 CH2 - CH3 结构域,可与人类 IgG 亚型、IgM、IgA 和 IgE,以及小鼠 IgG1(弱)、IgG2a 和 IgG2b 的 Fc 部分结合。也可与其他物种(包括猴、兔、猪、豚鼠、狗和猫)的 IgG 结合。
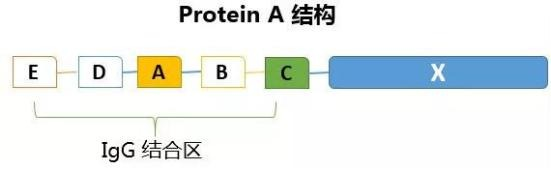
图4 Protein A的结构域示意图
2. Protein G:广谱Fc/Fab结合的“全能选手”
(1)基础特性:由链球菌的特定基因编码,分子量因菌株不同存在差异,如 G148 菌株来源的 Protein G 分子量为 65kDa,C40 菌株的则为 58kDa。其 UniProt 数据库登记号为 P19909,天然状态下通过特定结构锚定于细菌细胞壁表面,重组型常通过大肠杆菌表达,且经改造去除冗余结构以优化性能。
(2)结构特点:核心结构包含 2 - 3 个高度同源的 IgG 结合结构域,位于分子的 C 端。此外,天然 Protein G 的 N 端还有 3 个同源结构域,负责结合白蛋白,同时存在可结合人类 α - 2 - 球蛋白的 E 区。不过重组 Protein G 通常会删除白蛋白结合位点,避免抗体纯化时血清白蛋白造成污染。整体无复杂的二硫键依赖结构,稳定性较强。
(3)结合特性:核心优势是结合抗体的广谱性和高亲和力,主要结合 IgG 的 Fc 区,对多种物种的 IgG 均有良好结合能力,比如人类、小鼠、兔、山羊、牛等的多克隆或单克隆 IgG。它不仅能结合 Protein A 亲和力低的人类 IgG3、小鼠 IgG3 等亚型,还可少量结合部分抗体的 Fab 段。相较于 Protein A,其与多数 IgG 的结合亲和力更高,且结合受 pH 影响较小,适配更多实验场景。
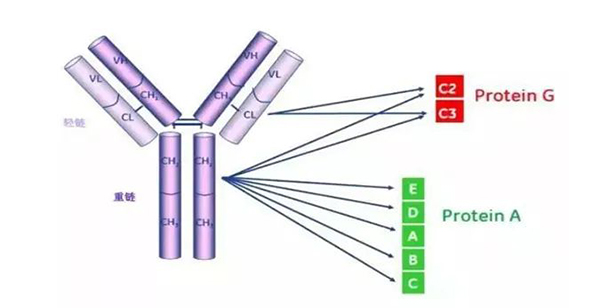
图5 Protein G与Protein A的结合位点差异
3. Protein L
(1)基础特性:Protein L从厌氧菌株化脓隐秘杆菌细胞壁上的蛋白分子,分子量为 95kDa,等电点(PI)为 4.0。天然状态下可从细菌细胞壁提取,也能从细菌培养基中分离,且重组型常通过基因工程改造去除细胞壁、细胞膜结合等冗余区域,以提升抗体结合效率。其基因包含信号序列、氨基端区域、Ig 结合重复区等多个功能模块,无链间二硫键,也不由二硫键连接的亚基构成,整体为细长的纤维状分子。
(2)结构特点:氨基酸序列包含 18 个氨基酸的信号肽、79 个残基的氨基端 A 区、5 个 72 - 76 个氨基酸的同源 B 重复区、两个 52 个氨基酸的 C 重复区,还有跨细胞壁的脯氨酸富集区及疏水膜锚定区。其中,5 个 B 重复区是结合免疫球蛋白轻链的核心结构域,该结构域折叠形成 α - 螺旋与四链 β - 折叠的组合构象,这种构象是其特异性结合抗体的结构基础。
(3)结合特性:与 Protein A、Protein G 结合抗体 Fc 区不同,它仅特异性结合免疫球蛋白的 κ 轻链可变区,不与抗体重链作用,且不干扰抗体抗原结合位点的功能。它可结合人、小鼠、大鼠等多个物种的抗体,能适配 IgG、IgM、IgA、IgD、IgE 等多种抗体类型,但对人类 κ 轻链的 κII 亚型及 λ 轻链结合能力极弱甚至不结合。
4. Protein A/G
以基因工程方法重组的Protein A/G包含Protein A的5个免疫球蛋白结合区域和Protein G的2个结合区域,结合能力较单一的Protein A和Protein G有很大提高。更强的Fc段结合能力使之成为免疫球蛋白纯化更受青睐的工具。Protein A/G结合人的所有IgG亚型和IgA、IgE、IgM及少量的IgD。

参考文献
1. Affinity Purification of Antibodies. Hnasko, R.M., et al. Humana Press, New York, NY. 2015.
2. Purification of antibodies using affinity chromatography. Kent UM. Methods Mol Biol. 1999. [PMID: 10098161]
3. Use of staphylococcal protein A as an immunological reagent. Goding JW. J Immunol Methods. 1978. [PMID: 349081]
4. Protein G: a powerful tool for binding and detection of monoclonal and polyclonal antibodies. Akerström B, et al. J Immunol. 1985. [PMID: 4031496]
5. Affinity chromatography: A versatile technique for antibody purification. Arora S, et al. Methods. 2017. [PMID: 28012937]
6. Protein L: an immunoglobulin light chain-binding bacterial protein. Characterization of binding and physicochemical properties. Akerström B, et al. J Biol Chem. 1989. [PMID: 2479638]
7. Mapping of the immunoglobulin light chain-binding site of protein L. Wikström M, et al. J Mol Biol. 1995. [PMID: 7608965]