298-14-6
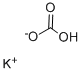 298-14-6 结构式
298-14-6 结构式
基本信息
碳酸氢钾
重碳酸钾
碳酸氢钾, ACS, 99.7-100.5% (DRIED BASIS)
POTASSIUM BICARBONATE
POTASSIUM HYDROGEN CARBONATE
Carbonicacid,monopotassiumsalt
Carbonicacidmonopotassiumsalt
bicarbonate
Potassion bicarbonate, Ph. Eur
POTASSIUM HYDROGENCARBONATE, REAGENTPLUS , 99.99+%
POTASSIUM BICARBONATE INSECT CELL*CULTUR E TESTED
POTASSIUM HYDROGENCARBONATE, REAGENT GRADE, >=98%
POTASSIUM HYDROGEN CARBONATE EXTRA PURE, DAB, B. P. C., U. S. P.
SODIUM BICARBONATE SOLUTION, SATURATED, TECHN., S42, 50 L
POTASSIUM HYDROGEN CARBONATE PH HELV
POTASSIUM HYDROGENCARBONATE REAGENT GR&
POTASSIUM HYDROGEN CARBONATE, GRANULAR, 99.7%, A.C.S. REAGENT
POTASSIUM HYDROGENCARBONATE GRANULAR &
POTASSIUM BICARBONATE USP
SODIUM BICARBONATE SOLUTION, SATURATED, TECHN., S42, 1 L
PotassiumHydrogenCarbonateA.R.
PotassiumHydrogenCarbonateUsp
物理化学性质
λ: 280 nm Amax: 0.01
安全数据
应用领域
制备方法
K2CO3+CO2+H2O→2KHCO3
离子交换法 氯化钾溶液经除钙、镁逆流通人离子交换柱,使钠型树脂(R-Na)变成钾型(R-K),用软水洗去氯离子后,将碳酸氢铵溶液顺流通过树脂交换柱,得到碳酸氢钾和碳酸氢铵的混合稀溶液,经蒸发分解使大部分分解为碳酸钾,溶液送碳化塔进行碳化生成碳酸氢钾,再经结晶、分离、洗涤、干燥,制得碳酸氢钾成品。其
R-Na+KCl→R-K+NaCl
R-K+NH4HCO3→R-NH4+KHCO3
2KHCO3→K2CO3+CO2↑+H2O
K2CO3+CO2+H2O→2KHCO3
K2CO3+CO2+H2O→2KHCO3
常见问题列表
22.5g/0℃;27.4g/10℃;33.7g/20℃;39.9g/30℃;47.5g/40℃
65.6g/60℃
GRAS(FDA,§184.1613,2000)。
GB 2760—1997:矿物质饮料0.033g/L;需膨松剂的各类食品,GMP;乳与乳制品按有关规定执行。
(1)取碱液废水5.0kg,其K+浓度为251.6mg/L(以K2O计),Na+浓度180.0mg/L(以Na2O计),SiO32-浓度30.5mg/L(以SiO2计),AlO2-浓度在18.2mg/L(以Al2O3计)。在一个大气压(1.0atm,101.3kPa)下,经磁力搅拌,通入CO2气体酸化碱液废水,待碱液废水pH值达7.8-8.2,出现由Si杂质沉淀和Al杂质沉淀构成的白色沉淀,抽滤、洗涤,弃去白色沉淀,获得滤液A;
(2)滤液A采用常压蒸发浓缩工艺,蒸发温度约100℃,滤液A密度从1.05g/cm3变至1.28g/cm3,待温度将至室温,体系在室温下结晶2.0h,出现大量白色晶体,即为含有结晶水的Na2CO3晶体;分离得到含有结晶水的Na2CO3晶体和滤液B,对含有结晶水的Na2CO3晶体煅烧,煅烧温度300℃,时间2.0h,获得Na2CO3产品(纯度>99.9%,达到分析纯要求);
(3)将滤液B置于高压釜中,加入高压CO2,控制滤液B的pH值在7.0,平衡压力P=0.3MPa,结晶时间为2.0h,此时,在K-Na-HCO3-溶液体系中亦出现晶体沉淀,分析结果,该晶体是KHCO3·xH2O(x=0.5-1.0),分离、冷水洗涤,即获得精制KHCO3。
(4)将上步骤得到的K-Na-HCO3-溶液进一步在常压下90℃蒸发,获得结晶物亦为KHCO3结晶水合物;过滤分离、冷水洗涤,亦可获得KHCO3晶体和滤液C。
(5)将第3步和第4步得到的精制KHCO3合并,80℃下真空干燥6h,获得食品级KHCO3。
(6)将滤液C与第3步、第4步的洗涤液混合加入下一轮的5.0kg碱液废水,进行重复上述操作工艺,循环五次,计算产物KHCO3与25.0kg原废水碱液中的钾总量比照,收率为90.5%。
