简介
糖尿病(Diabetes Mellitus,DM)是由于体内胰岛素不足或其作用受损所引起的以慢性高血糖和葡糖糖耐受为主要特征,合并脂肪和蛋白质代谢紊乱的综合征。随着糖尿病病程的延长,患者易并发心、脑、肾、视网膜及神经系统慢性进行性病变。世界卫生组织(WHO)于1999年将糖尿病分为I型糖尿病(T1DM)、II型糖尿病(T2DM)、妊娠糖尿病及特殊类型糖尿病4类。其中I型糖尿病是一种自身免疫系统疾病,表现为胰岛β细胞分泌胰岛素的功能受损,体内胰岛素绝对缺乏。II型糖尿病又称为非胰岛素依赖型糖尿病,是由组织细胞的胰岛素抵抗、胰岛β细胞功能衰退和其他多种原因引起的。在糖尿病患者中,II型糖尿病约占80%。目前,糖尿病的发病机制尚未完全阐明,通常认为其发病是遗传因素和环境因素共同作用的结果。
2014年全球估计有4.22亿成人患有糖尿病,相比之下,1980年时有1.08亿人。全球糖尿病(年龄标化)患病率自1980年以来增加了近一倍,在成人中从4.7%上升到8.5%。过去十年中,低收入和中等收入国家中糖尿病患病率的上升速度超过了高收入国家。2012年糖尿病直接造成了150万人死亡。而血糖超标通过增加心血管病和其它疾病的风险导致了另外220万人死亡。这370万例死亡中43%发生在70岁之前。低收入和中等收入国家中发生在70岁之前的高血糖或糖尿病死亡百分比高于高收入国家。据预测,到2030年糖尿病将成为全球第七大死亡原因。
现今糖尿病的基本治疗措施包括饮食控制、运动和药物治疗,并以药物治疗占主要地位。其中,I型糖尿病的治疗主要是通过注射胰岛素或其类似物,而II型糖尿病患者不需要依靠胰岛素,可以使用口服降糖药物来控制血糖。目前治疗II型糖尿病的药物主要有,二甲双胍、磺酰脲类胰岛素分泌促进剂、噻唑烷二酮类(thiazolinediones,TZDs)胰岛素增敏剂、α-葡糖糖苷酶抑制剂以及二肽基肽酶抑制剂等。
二肽基肽酶IV (DPP-4)抑制剂
在体内循环中,糖尿病的水平是由胰岛素和胰高血糖素严格控制的。但也有其他激素参与葡萄糖浓度的调节。其中,肠道激素也称为肠促胰岛激素,现在被认为是非常重要的控制葡萄糖浓度的激素。两个主要的肠促胰岛激素是胰高血糖素样肽(GLP-1)和糖依赖性胰岛素释放肽(GIP)。进食时,促使胃肠道分泌肠促胰岛素,它们与β细胞表面特定的GPCRs作用,诱导胰腺中胰岛素的分泌。GLP-1能抑制胰高血糖素分泌、减少食欲和减缓胃排空,并可能在β细胞增殖和分化以及β细胞正常功能发挥其作用。研究发现,GLP-1的活性形式(GLP-1 7-36)的半衰期大约仅2min。它是由一种丝氨酸蛋白酶DPP-4迅速降解成GLP-1 9-36,而GLP-1 9-36不能促进胰岛素分泌。DPP-4也可以断裂其他的多肽,如GIP、PYY、NPY或GLP-2。
目前上市的DPP-4抑制剂有西格列汀(Sitagliptin,个上市的口服DPP-4抑制剂)、维达列汀(Vildagliptin)、沙格列汀(Saxagliptin)、阿格列汀(Alogliptin)、利格列汀(Linagliptin)、特力利汀(Teneligliptin)、奥玛格列汀(Omarigliptin),结构式如下图所示。
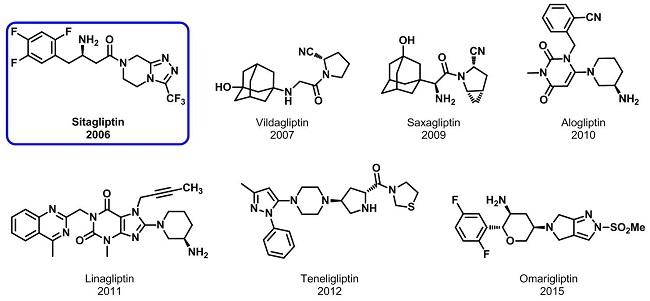
西格列汀的发现
西格列汀(Sitagliptin)是个上市的口服DPP-4抑制剂,由美国默沙东研制。2006年10月获得美国FDA批准西格列汀单独使用或与二甲双胍、噻唑烷二酮类药物联合使用,用于改善II型糖尿病患者的血糖控制;2007年10月,FDA批准西格列汀与二甲双胍联合使用用于糖尿病的初始治疗,且作为磺酰脲类或磺酰脲+二甲双胍无法控制血糖的附加疗法;2010年2月,FDA批准西格列汀可作为胰岛素的附加剂;2011年5月,日本批准西格列汀联合α-葡萄糖苷酶抑制剂使用;2011年9月,日本批准西格列汀联合胰岛素使用;2011年10月,FDA批准西格列汀+辛伐他汀复方制剂用于同时患有糖尿病和高脂血症的患者;2014年3月,日本批准西格列汀用于严重肾功能不全的II型糖尿病治疗;2014年5月,日本批准西格列汀联合其他口服药物用于II型糖尿病的治疗。
西格列汀上市次年,销售额即成功破亿(2007年销售额6.68亿美元),上市第三年即成功突破10亿美元(2008年销售额近14亿美元),且自2012年销售额突破40亿美元后,西格列汀的年销售额均在40亿美元以上,相对比较平稳。据汤森路透预测,西格列汀2021年的销售额将突破50亿美元,之后将有所下降。
1.药物化学研究过程
在开展对DPP-4抑制剂研究的项目时,默沙东的药物化学家通过两种不同途径寻找苗头化合物,即对默沙东的化合物库进行高通量筛选和对已发表的DPP-4抑制剂结构进行分析总结,进而设计结构新颖DPP-4抑制剂。当时文献披露的DPP-4抑制剂有NVP-728、LAF237(即后来上市的vildagliptin)、(S)-isoleucine thiazolidide 3和(S)-cyclohexylglycine pyrrolidide 4。化合物1和2对DPP-4都有很好的抑制作用,可能是由于DPP-4活性位点处的丝氨酸残基与化合物1和2中氰基形成共价键,这也可能是导致其PK性质不好的原因。文献表明,当分子结构中缺少氰基,其稳定性会增加,而对DPP-4的抑制作用会有所降低。最后,研究人员决定对化合物4的结构进行设计改造,以期能得到成药性好的小分子化合物。在环己烷的4位引入氨基和将吡咯环3位碳原子替换成杂原子,并进行活性测试。最终设计了化合物6-9,对DPP-4的抑制作用很好。
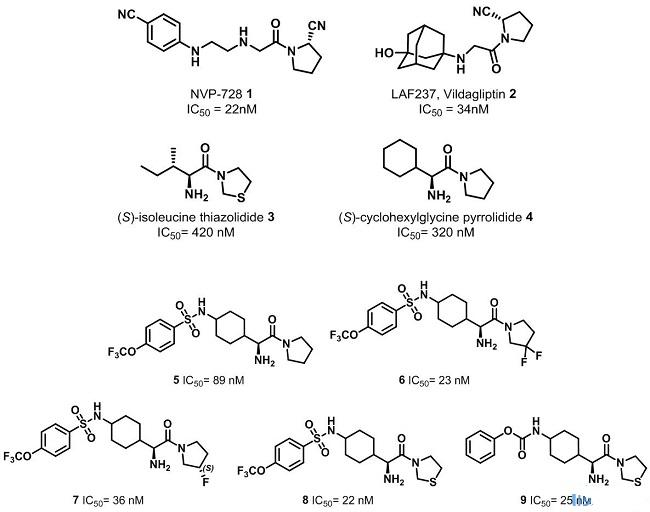
与此同时,默沙东在对化合物库进行高通量筛选,确定了两个苗头化合物,如下图所示。其中一个是β-氨基酸与脯氨酸的酰胺类衍生物,另一个是β-氨基哌嗪类衍生物。
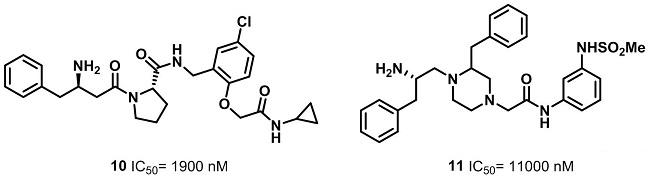
结合化合物6-9的构效关系,对苗头化合物10的结构进行优化,在此基础上,替换四氢吡咯环上的取代基,或者将四氢吡咯环换成噻唑烷,确保其对DPP-4的抑制活性变化不大。进而去掉四氢吡咯环上的取代基,降低了整个化合物的分子量。在研究中发现,芳环上有氟原子时,对活性有比较大的促进作用。
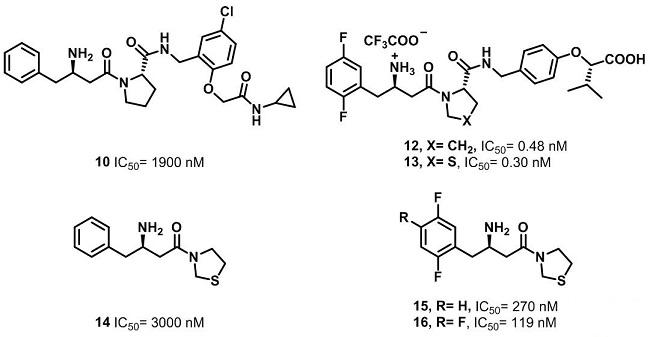
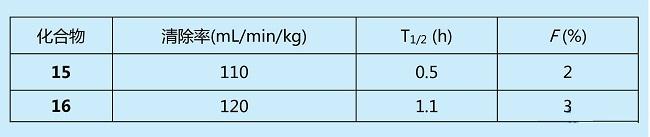
虽然化合物15,16对DPP-4的抑制活性很好,可惜在大鼠体内的PK性质很差,半衰期过短,口服生物利用度很低,具体数据见下表。
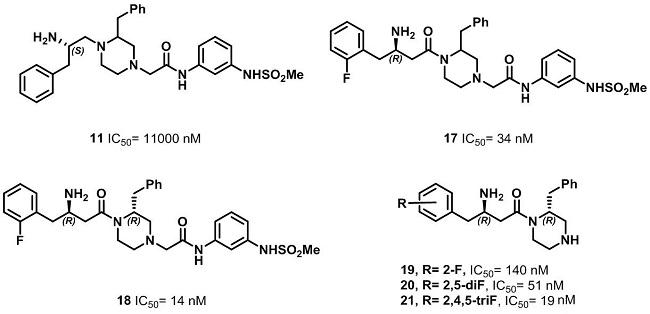
分析另一个苗头化合物β-氨基哌嗪类衍生物11的结构特点和化合物12-16的SAR结果,分别设计、合成一系列化合物,并进行了活性测试。研究人员对化合物11左侧的苯环,右侧的哌嗪环上的取代基以及分子中两个手性中心分别进行了结构改造,最终筛选出了化合物19-21,并进行了动物实验。但是这些化合物在动物体内的PK数据不好,如较高的清除率、较低的半衰期(小于2h)以及很低的口服利用度(小于4%),成药性很差。
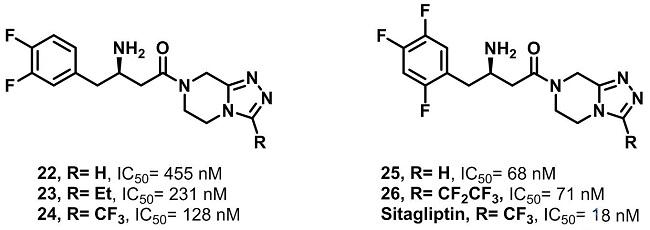
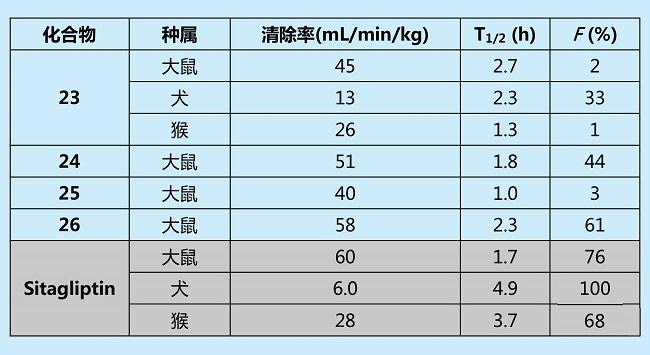
对上述化合物在肝微粒体酶中的代谢物研究发现,主要的代谢位点发生在哌嗪环上。于是对化合物中哌嗪环部分进行结构改造,再尝试了多种杂环后,确定将哌嗪环替换成三唑并哌嗪(triazolopiperazine),可以保持活性,并且增强了其代谢稳定性。
2.合成路线及工艺研究
早期,默沙东的研发人员由通过苄溴SM-2与SM-1反应得到中间体M-1,经Boc保护,酯水解得到M-2。中间体M-2经Arndt–Eistert反应得到同系物M-3,然后与SM-3反应生成酰胺,成盐即可得到西格列汀(Sitagliptin)。
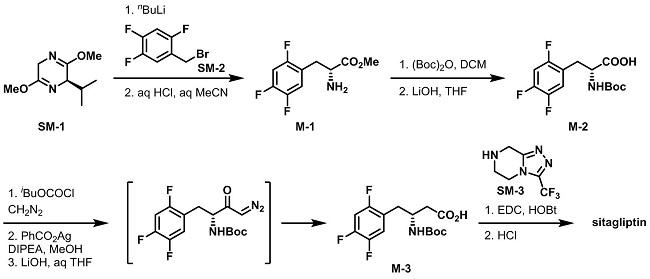
起始物料SM-3则是由水合肼与2-氯吡嗪反应得到M-4。M-4与三氟醋酸酐形成M-5,进而在多聚磷酸的作用下得到M-6。对M-6氢化,得到起始物料SM-3。
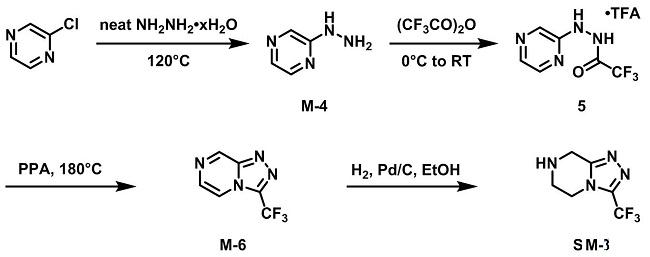
在上述合成路线中,西格列汀(Sitagliptin)结构中唯一的手性中心是通过手性辅基控制引入的,在后续合成中,涉及保护基的使用,增加了操作步骤。出于绿色化学和原子经济性的考虑,在随后的工艺开发中,Merck的研究人员尝试不对称的催化氢化引入手性。β-酮酯31是通过酸30用Masamune条件转化得到的。β-酮酯31的不对称氢化是用修饰的(S)-联萘二苯磷催化剂进行的。将所得到的手性酯水解得到酸32,收率优良,且ee值为94%。酸32和邻苄基羟胺在EDC作催化剂下偶联得到异羟肟酸33。异羟肟酸33通过Mitsnobu反应闭环得到β-内酰胺34,用甲醇重结晶得到34的收率是81%(从化合物32),同时提升了光学纯度,ee值高达99%。对β-内酰胺34水解,然后与三氮唑偶联,氢化,成盐,得到西格列汀(Sitagliptin)。
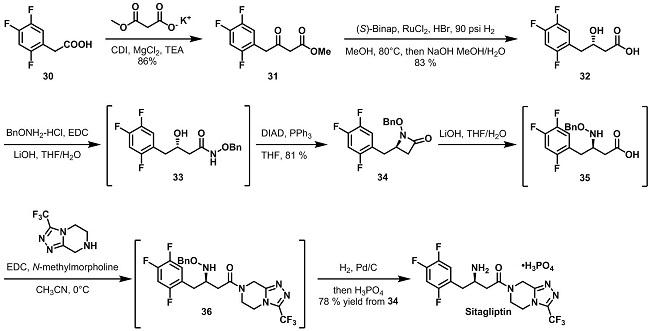
从酸30合成西格列汀(Sitagliptin)的总收率为45%。路线相当长,但是每步的收率比较高,Merck用这条路线制造了约100kg的API,用于早期安全性评价和临床试验。但是从绿色化学角度来看,有不少缺点:
使用高分子量的试剂将羟基转化成氨基,是路线变得较为繁琐;
Masamune条件需要很高的稀释度,达到30L/kg,限制了该工艺的生产能力;
两步偶联反应使用了原子经济性低的试剂EDC;
Mitsunobu反应,产生大量副产物,原子利用度很低。
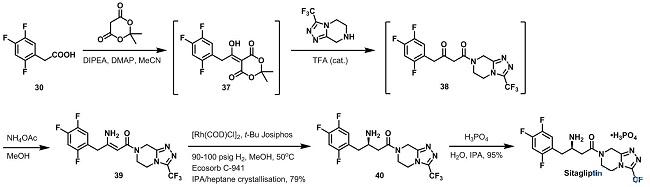
鉴于以上缺陷,Merck公司决定开发新的工艺路线。通过在底物酸30上引入Meldrum’s acid,得到加合物37,37不需要提纯即可与三氮唑反应得到β-酮酰胺38。38也可以不需要提纯,通过加入醋酸铵的甲醇溶液转化成烯胺39。从酸30到烯胺39的总收率为84%。
经过很多筛选尝试后,Merck的研究人员发现烯胺39在[Rh(COD)Cl]2和t-Bu Josiphos作用下可以发生不对称氢化反应。在这步转化过程中,不需要使用保护基即可达到很好的ee值。反应结束后,用Ecosorb C-941吸附剂将90-95%的铑回收,然后成盐得到西格列汀(Sitagliptin)。
在西格列汀(Sitagliptin)生产工艺中引入新型的不对称氢化技术,使得工业垃圾下降80%,同时把成本下降70%。同样生产1公斤西格列汀原料药只产生44公斤工业垃圾,而工业废水则下降到0!每生产1000公斤西格列汀原料药,为地球少产生220 000公斤的工业垃圾。为此,Merck公司西格列汀的化学工艺团队荣获2006年度“总统绿色化学挑战奖(Presidential Green Chemistry Challenge Award)”。
虽然不对称氢化路线能降低生产中产生的废弃物,但是也有着一个显著的环境劣势存在。铑是一种极为罕见的金属,仅仅以4μg/kg的含量存在于地壳中。由于这种稀缺性,铑的市场价格波动很大:从2006年初到2008年7月(全球经济衰退前),铑的价格从每盎司3000美元涨到每盎司10000美元。由于铑的不可再生性,会导致西格列汀(Sitagliptin)生产成本的逐年上升。
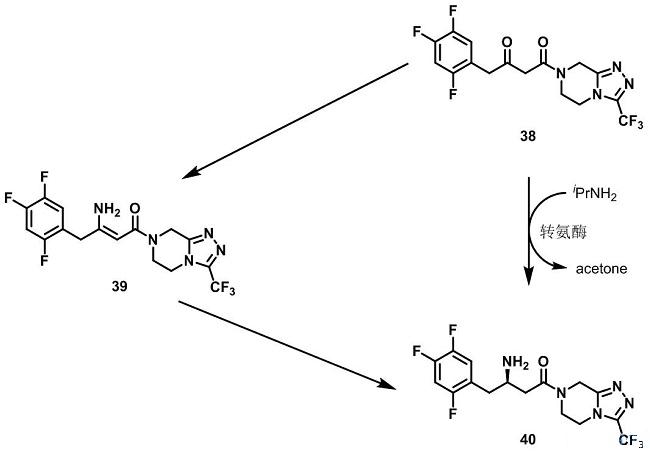
考虑到以上因素,Merck公司和Codexis公司合作,开发了更加绿色环保的工艺来生产西格列汀(Sitagliptin)。他们通过转氨酶直接将酮38转化成所需要的手性胺40。Codexis公司的研究人员改进了一个生物催化剂使得新工艺路线可以避免原工艺加氢步骤,并且生物催化活性提高2500倍,同时没有副产物生成。最新的酶法合成工艺避免了高压加氢操作以及后续的贵金属催化剂回收。新工艺在减少了原有工艺条件下10-13%的总占地和19%的废料产生,同时还增产56%。2010年,Merck公司和Codexis公司获得“总统绿色化学挑战奖-更绿色的反应条件奖(Presidential Green Chemistry Challenge Award - Greener Reaction Conditions Award)。Merck公司还表明他们计划备案新的合成路线,采用转氨酶路线取代不对称氢化路线来商业化生产西格列汀(Sitagliptin)。
小结
作为全球首个上市的DPP-4抑制剂,西格列汀(Sitagliptin)自2006年上市至今,不仅为Merck公司创下了高额的销售额,还引领了大批DPP-4抑制剂上市。近年来西格列汀(Sitagliptin)销售额超过40亿美元,是当之无愧的明星药物!凭借上市十多年的显著临床疗效,西格列汀(Sitagliptin)经受住了市场的考验,通过追溯西格列汀(Sitagliptin)的研发历程,也为其他DPP-4抑制剂的开发提供了一个机会。
参考文献
Bioorg. Med. Chem. Lett. 1996,6,1163–1166
Bioorg. Med. Chem. Lett. 2004,14,43–46
Bioorg. Med. Chem. Lett. 2004,14,1265–1268
Bioorg. Med. Chem. Lett. 2004,14,4759–4762
Bioorg. Med. Chem. Lett. 2004,14,4763–4766
Bioorg. Med. Chem. Lett. 2004,14,5151–5155
J. Med. Chem. 2005,48,141–151
J. Med. Chem. 2006,49,3614–3627
J. Med. Chem. 2008,51,589–602
Org. Process Res. Dev. 2005,9,634–639
Org. Process Res. Dev. 2006,10,723–726
Science 2010,329 (5989),305–309
