5 月 20 日,CDE 官网显示,拜耳在国内递交硫酸 Larotrectinib 胶囊上市申请并获受理(受理号:JXHS2101015)。
Larotrectinib 是Loxo Oncology 公司和拜耳公司开发的新一代具备高度特异性的口服 TRK 抑制剂,能够高选择性地结合 NTRK 融合基因编码的蛋白产物,阻断下游信号通路的激活和传递,从而抑制存在这些突变的癌细胞生长和增殖,发挥抗癌作用。
2019 年 1 月 7 日,礼来公司以 80 亿美元收购 LOXO,包括 Larotrectinib 一半的权益,以及管线中的其他产品。
2018 年 11 月 26 日,美国 FDA 加速批准 larotrectinib(商品名 Vitrakvi,代号 LOXO-101,拉罗替尼)用于治疗携带 NTRK 基因融合的成年和儿童局部晚期或转移性实体瘤患者,不需考虑癌症的发生区域。这是个获得 FDA 批准的不分癌种,只看突变的广谱抗癌靶向药,并且被证明在 17 种儿童和成人肿瘤中都有效;也是个针对 NTRK 融合突变的靶向药。
Larotrectinib的分子结构式(图片来源:维基百科)
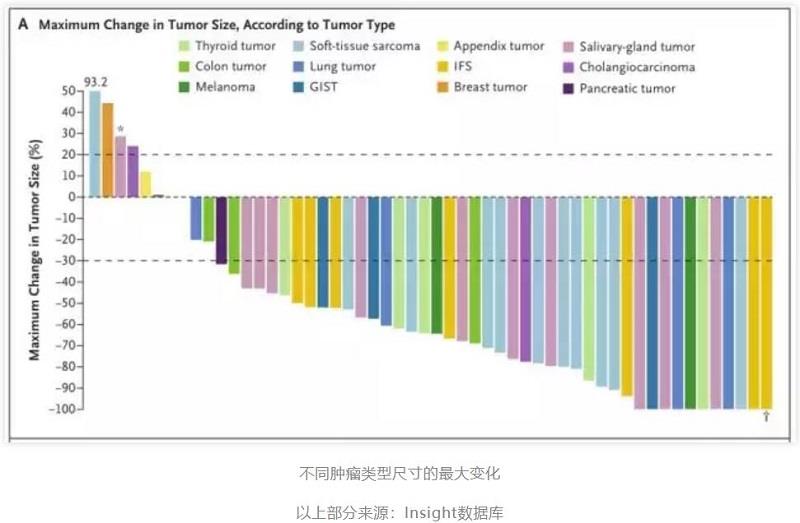
2018 年 2 月 22 日,NEJM 正式发表 Larotrectinib 的综合研究结果。共包括三个临床研究:I 期成人,I/II 期儿童以及 II 期青少年和成人,一共 55 例患者共 17 种不同类型 NTRK 融合的恶性肿瘤。
研究主要终点(整合分析)为 ORR,次要重点为反应持续时间,PFS 和安全性。55 例患者年龄跨度从 4个月到 76 岁,ORR 为 75%(独立评审)和 80%(医生评审)。
一年时,71% 的治疗反应持续且 55% 的患者未发生疾病进展,中位随访 9.4 个月,86% 有治疗反应的患者持续接受治疗,有些甚至获得治愈目的的手术治疗。
总体安全性良好,大多为 1-2 级不良事件,未发生与药物相关大约 5% 的 3-4 级 AE。
来源:Clindata
